Panorama des soins d’urgence ophtalmologique
Organisation et qualité du soin non programmé
J.-L. BOURGES, J.-C. RIGAL-SASTOURNÉ, B. COCHENER-LAMARD
-
La loi « hôpital, patients, santé et territoire » (HPST) définit le cadre actuel de l’organisation de la prise en charge des urgences, au niveau du service public comme en exercice libéral.
-
Les ophtalmologistes libéraux sont tenus d'organiser une permanence de soins dans leur territoire.
-
Les structures d'urgence sont agréées par les Agences régionales de l’hospitalisation (ARH) sous certaines conditions, dont l’engagement « zéro refus ».
-
Les Agences régionales de santé (ARS) ont publié un cahier des charges à respecter pour les structures d'urgence en ophtalmologie.
-
Les critères et indicateurs de qualité d'une structure d'urgence en ophtalmologie sont établis à partir du référentiel défini par la Société française de médecine d'urgence (SFMU).
L’organisation des urgences et des permanences de soins est définie par la loi « hôpital, patients, santé et territoire » (HPST) [1]. Cette organisation est régie par les Agences régionales de santé (ARS) qui en précisent les modalités au travers d'un cahier des charges. Celui-ci est opposable aux structures de soins, aux structures d'urgence ainsi qu’aux praticiens qui exercent aux urgences générales [2] comme ophtalmologiques [3].
Les urgences générales sont schématiquement organisées autour (fig. 2-1-1) :
- –
des établissements de soins dotés de moyens ambulatoires de secours à distance, les services mobiles d'urgence et de réanimation (SMUR) ;
- –
des établissements de soins qui gèrent une structure d'urgence (SU) en plus d'un SMUR ;
- –
des brigades de sapeurs-pompiers et leurs moyens d'intervention mobiles ;
- –
d'un centre d'appel unique et d'une régulation : le service d'aide médicale urgent (SAMU) ;
- –
d'une société savante et de ses missions : la Société française de médecine d'urgence (SFMU).
Le secours est organisé autour d'une demande. Elle est formulée auprès d'un centre de régulation d'urgence commun. La régulation déclenche les moyens ambulatoires appropriés. Ils peuvent être mobiles terrestres (SMUR, brigade des sapeurs-pompiers) ou aériens (HéliSMUR). Les moyens mobiles acheminent vers une SU.
En réalité, il n’existe pas de secours particulier organisé autour de l’ophtalmologie et de ses spécificités (fig. 2-1-2). Le patient nécessitant une aide d'urgence ophtalmologique peut, comme tout autre, s’adresser au système de secours général. En miroir, il arrive naturellement que le système de secours général prenne en charge des problématiques ophtalmologiques isolées, afin de diriger le patient vers une structure d'urgence générale adaptée ou spécialisée lorsqu’elle existe à proximité. À la différence des urgences générales qui sont accueillies dans des structures d'urgence à 80 % hospitalières de service public, la prise en charge des urgences ophtalmologiques est très diversifiée. L’ophtalmologie d'urgence, par son caractère majoritairement ambulatoire, se prête tout particulièrement à ce que le patient s’adresse lui-même au recours sanitaire d'urgence de son choix, libéral ou public, en cabinet ou en structure hospitalière.
Le rapport commandé en 2012 auprès de l’Académie de médecine et conduit par Jean-Louis Arné fournit un état des lieux des urgences ophtalmolgiques qui s’appuie sur des références provenant de la Direction de la recherche, des études, de l’évaluation et des statistiques (DRESS).
Il apparaît que, dans leur grande majorité, les passages aux urgences dans les centres hospitaliers sont ordonnés directement par les secouristes, le SAMU ou le patient lui-même, éventuellement doté d'une lettre de son médecin. L’organisation de la prise en charge se fait souvent, faute de médecin disponible, par une sélection préalable assurée par l’infirmer(ière). Idéalement, ce(cette) dernier(ière) pourrait tirer bénéfice d'un organigramme pouvant l’orienter vers les priorités (voir chapitre 2.5.5). Ainsi, certains centres fournissent, par exemple, la liste des items, symptômes et contextes d'urgences aiguës : brûlures chimiques, infection postopératoire, plaie du globe, altération visuelle brutale, diplopie soudaine, douleur avec ou sans rougeur, enfant de moins de 6 ans. Dans les centres hospitaliers universitaires, la gestion est en règle assurée par un interne qui sollicite si besoin le senior d'astreinte. Dans les hôpitaux généraux, il peut exister une astreinte assurée par un ophtalmologiste à temps plein ou parfois par des praticiens libéraux, sachant que ces organisations sont souvent difficiles à assurer dans certains territoires ou du fait de la faible rémunération des astreintes. En milieu libéral, dans les grandes villes, les gros cabinets de groupes peuvent être organisés autour d'un système de garde, destiné avant tout à suivre les patients opérés en offrant un niveau d'urgence médicale, alors que les urgences chirurgicales sont orientées vers les structures hospitalières.
Le 22 mai 2006, les décrets n° 2006-576 et n° 2006-577 ont été promulgués visant à regrouper l’ensemble des structures des urgences régies par la loi de 1997 sous le seul intitulé « structure d'urgence » (SU). Cet intitulé englobe et remplace donc les intitulés précédents de service d'accueil des urgences (SAU), d'unité de proximité d'accueil, de traitement et d'orientation des urgences (UPATOU) et de pôle spécialité urgence (POSU). Le premier décret modifie le Code de la santé publique en redéfinissant la « médecine d'urgence ». Le second précise les conditions techniques de fonctionnement applicables aux SU.
Un établissement de santé peut être autorisé à exercer la médecine d'urgence sur au moins un critère des trois modalités fixées :
- –
la régulation des appels adressés au SAMU ;
- –
la prise en charge des patients par la structure mobile d'urgence et de réanimation (nouvelle appellation gardant le signe SMUR) ;
- –
ou sur le versant pédiatrique, le circuit spécifique du SMUR et des structures des urgences pédiatriques.
L’agrément est délivré par l’Agence régionale de l’hospitalisation (ARH). C’est elle qui précise la ou les modalités d'exercice de l’activité autorisée. Le décret défini que tout établissement disposant d'une SU générale ou pédiatrique doit « accueillir en permanence dans sa structure toute personne qui s’y présente en situation d'urgence ou qui lui est adressé, notamment par le SAMU ». Ce texte exclut de ce fait la fermeture nocturne des services. Plus précisément, pour être autorisé à disposer d'une SU, l’établissement doit disposer de lits d'hospitalisation complète en médecine et d'un accès à un plateau technique. Le plateau technique peut être interne ou conventionné avec un autre établissement, un cabinet d'imagerie, un laboratoire d'analyse de ville ou en réseau de structures.
Un établissement peut être autorisé à ne faire fonctionner sa SU qu’une partie de l’année sous réserve que la prise en charge des patients soit orientée le reste du temps dans le cadre d'un réseau organisé. Citons pour exemple certains services périphériques d'ophtalmologie ne pouvant assurer la permanence des soins tout au long de l’année faute de ressources humaines. Ils orientent alors périodiquement par convention les demandes de soins non programmés d'ophtalmologie (DSNPO) vers le centre hospitalier universitaire (CHU) de proximité.
Par arrêté du ministre de la Santé, le décret n° 2006-577 prévoit le seuil minimal d'activité de 15 000 passages annuels. Cependant, un établissement qui n’atteint pas cette limite peut être autorisé à disposer d'une SU s’il participe à une fédération médicale inter-hospitalière ou à un regroupement de coopération sanitaire.
Au-delà de ces dispositions, un établissement de santé ne disposant pas de SU reste contraint de répondre aux obligations générales de secours et de soins vis-à-vis des personnes en danger qui s’adresseraient à lui.
On dénombrait en 2014 un total de 723 SU labellisées dans les 3 300 établissements de santé français. Un quart des SU appartenait au secteur privé [4]. Trois quarts des SU relevaient du secteur public, dont celles des 32 centres hospitaliers universitaires (CHU)/centres hospitaliers régionaux (CHR). Parmi ces derniers, en 2017, 90 % d'entre eux avaient organisé un accueil des DSNPO, capable de prendre en charge chaque item d'urgence (tableau 2-1-1). Les établissements possédaient une partie de leur SU dédiée à l’ophtalmologie dans 55 % des cas. En revanche, seuls 45 % d'entre eux disposaient d'une garde d'ophtalmologie médicalisée.
| N = | |
|---|---|
| Service d'ophtalmologie possédant un accueil d'urgence en ophtalmologie | 30 |
| Service d'ophtalmologie doté d'une astreinte d'ophtalmologie | 30 |
| Service d'ophtalmologie doté d'une garde d'ophtalmologie | 14 |
| CHU/CHR doté d'une SU dédiée aux urgences ophtalmologiques | 22 |
| CHU/CHR doté d'une SU générale accueillant les urgences ophtalmologiques | 19 |
| Estimation du nombre annuel total de passage en SU de CHU pour DSNPO | 391 650 |
* Métropole et départements et régions d'outre-mer.
Le degré d'urgence des principaux items d'urgence ophtalmologique tente d'être approché dans cet ouvrage au travers des notions de sévérité, de triage, de pronostic et de prise en charge. Pour autant, rares sont les consensus sur le sujet. L’ARS a proposé une typologie d'urgence en distinguant les urgences immédiates et vitales, les urgences des 24 heures et les autres urgences, différées (tableau 2-1-2) [5, 6]. Cette typologie peu détaillée a pour objectif de contribuer à l’organisation de la permanence des soins des établissements de santé (PDSES) de nuit profonde à l’échelle territoriale. Le triage en ophtalmologie d'urgence fait appel à une typologie plus détaillée (voir chapitre 2.5.3 et tableau 2-5-2 ) pour mieux affiner la prise en charge à l’échelle d'une structure de soins.
| Urgences immédiates | Urgences des 24 heures |
|---|---|
| Diplopie brutale/aiguë:anévrisme ou dissection | Œdème palpébral, cellulite orbitaire, kératite |
| Cécité brutale:OACR, OVCR, NORB, NOIA | Corps étranger cornéen |
| Baisse d'acuité visuelle en rapport avec des vascularites de type Horton |
|
| Endophtalmie | DMLA hémorragique |
| Infections, abcès de cornée | Ablation d'un corps étranger cornéen |
| Hypertonie aiguë, CAFA | Uvéite antérieure ou postérieure |
| Traumatisme chimique, brûlures oculaires | Phosphène chez le myope |
| Traumatisme mécanique, corps étranger intraoculaire | Cellulite orbitaire |
| Plaie orbito-palpébrale et oculaire | Abcès cornéen, ulcération cornéenne |
| Fracture de l'orbite | Rejet de greffe |
| Score | Délai de prise en charge ophtalmologique | Soin ophtalmologique | Délai d'accès à l'ophtalmologiste |
|---|---|---|---|
| 1 | Sans délai | Triage 1 | Catégorie 1 |
| 2 | < 1 heure | Triage 2 | Catégorie 2 |
| 3 | < 6 heures | Triage 3 | Catégorie 3 |
| 4 | < 24 heures | Triage 4 | Catégorie 4 |
| 5 | < 72 heures | Triage 5 | Catégorie 5 |
| 6 | < délai de consultation habituel | Triage 6 | Catégorie 6 |
* Il s'inspire de l'échelle de triage australienne conçue par l'Australian College of Emergency Medicine. Seuls les triages 1, 2 et 3 s'appliquent à la consultation d'urgence. Au-delà d'un délai de 6 heures, la priorisation d'une DSNPO par rapport à une autre n'est plus utile et l'ordre d'arrivée détermine celui du passage en consultation d'urgence.
La participation pour un établissement de santé à la mission de PDSES en ophtalmologie est réglementée par les ARS. Celles-ci ont édité un cahier des charges à respecter [3]. Il est opposable en SU ophtalmologique, sous peine de voir les financements dédiés « mission d'intérêt général »» (MIG) révisés. Il comporte des points contractuels pour assurer la mission de PDSES en ophtalmologie. Les établissements dotés d'une SU labellisée doivent disposer d'une gouvernance interne et territoriale de la PDSES, d'un coordonnateur de la PDSES pour l’établissement, de ressources dimensionnées pour assurer la mission de PDSES. Ils doivent s’engager à une politique du « zéro refus », favoriser le retour des patients vers les établissements d'origine le cas échéant, participer au suivi et à l’évaluation de leur dispositif et garantir l’accessibilité aux soins d'urgence.
Le but des tutelles est d'améliorer la réponse apportée aux demandes, les filières de soins, l’interactivité avec le premier recours hors établissement de santé et, bien sûr, les délais d'attente.
Bien que ne concernant que les soins d'ophtalmologie de nuit (20 heures-22 heures 30) et nuit profonde (22 heures 30-8 heures), le cahier des charges de l’ARS dessine des bases pour un standard de qualité des structures d'urgence en ophtalmologie (encadré 2-1-1).
Encadré 2-1-1
Le cahier des charges de l’ARS dessine des bases pour un standard de qualité des structures d'urgence en ophtalmologie. Les points spécifiques sont les suivants :
-
les structures d'urgence d'ophtalmologie ne doivent pas refuser de prendre en charge un patient dans leur champ de compétence, en particulier au motif que celui-ci n’appartient pas à leur zone de couverture territoriale ;
-
l’établissement doit identifier un coordinateur dont la mission est d'articuler la prise en charge des urgences ophtalmologiques avec les entités non ophtalmologiques. Par exemple, il organise et protocolise l’accès des patients d'ophtalmologie à un bloc commun, à une hospitalisation non ophtalmologique (lits d'aval), les éventuels transferts, etc. Il orchestre la réponse à la régulation médicale générale et, inversement, la régulation ophtalmologique pour les demandes afférentes. Il supervise les gardes et astreintes dans la structure d'urgence ;
-
les moyens pour accueillir les urgences doivent être proportionnés à la demande territoriale. Ils sont identifiés comme étant les médecins ophtalmologistes libéraux volontaires ou du service public, les anesthésistes, les infirmiers – infirmiers de bloc opératoire (IBODE) et infirmiers anesthésistes diplômés d'État (IADE) –, les lits d'hospitalisation « y compris lors des pics d'activité prévisibles » et les moyens d'imagerie et/ou laboratoires réputés nécessaires ;
-
une formalisation du parcours du patient et de sa prise en charge par la SU et ses équipes. Cette formalisation est précisément décrite à l’avance et connue.
Quelques principes de prise en charge sont évoqués :
-
limiter les transferts des patients autant que possible ;
-
limiter les seconds passages et contrôles au niveau de la structure d'urgence ;
-
la prise en charge chirurgicale, quand elle est indiquée, doit être possible sans délai dans l’établissement de la SU. Les chirurgies programmées à distance ou les transferts secondaires sont à éviter. Par exemple, dans le cas d'une endophtalmie, la réalisation sans délai d'une ponction de chambre antérieure (PCA) + injection intravitréenne (IVT) dans une salle adaptée [7], accessible en permanence, doit être possible dans la SU ou à proximité immédiate ;
-
les moyens ambulants (SMUR, ambulances, pompiers) doivent pouvoir identifier un point de prise en charge dans la structure d'urgence. Une fois le relais de prise en charge effectué, l’équipe de la SU a la pleine responsabilité du patient et de ses transports ultérieurs le cas échéant ;
-
la SU doit s’engager à ne refuser aucun patient adressé par des services de régulation médicale ou des établissements de santé qui n’assurent pas la permanence des soins nocturnes ;
-
la totalité du parcours de prise en charge d'urgence doit se faire au tarif opposable, sans reste à charge pour le patient ;
-
la qualité de fonctionnement de la SU peut être évaluée avec des indicateurs de qualité et un registre de situations non conformes.
L’évaluation se fonde sur le référentiel définit par la SFMU [8]. Ce document, établi en 1997, visait à recenser les critères de qualité du fonctionnement des SU ; il était destiné initialement aux services d'accueil des urgences et aux unités d'hospitalisation de courte durée, puis il a été finalement adressé à toutes les structures d'urgence dans la globalité de leurs missions.
Le référentiel définit en particulier le terme de « procédure », comme une manière spécifique d'accomplir une tâche concernant l’ensemble du personnel et régulièrement réactualisé. Elle est qualifiée par les marqueurs « E » pour essentiel, « S » pour souhaitable et « O » pour optionnel. Ce référentiel permet d'aboutir à des indicateurs chiffrés, qui portent sur l’activité, les moyens ainsi que le coût de l’urgence.
L’activité est ainsi quantifiée par :
- –
l’environnement : nombre d'entrées directes, consultations externes, provenance des urgences, etc. ;
- –
l’accueil des urgences : nombre de passages annuels, nombre de cas relevant de la traumatologie, nombre de passages après avis médical extérieur, taux d'occupation ponctuel, pourcentage de patients pris en secteur sanitaire, pourcentage de patients hospitalisés, pourcentage de passages bénéficiant des moyens disponibles dans l’établissement, nombre de plaintes au cours des trois dernières années, flux d'urgence par tranches horaires, nombre d'interventions chirurgicales urgentes entre 20 heures et 7 heures provenant des urgences, etc. ;
- –
l’activité de l’unité d'hospitalisation de courte durée (UHCD).
Les moyens sont reflétés par le nombre de malades pris en charge par agent et par an, le temps passé par malade par un médecin, la qualité des espaces d'accueil et de la communication. Enfin, le coût comprend le coût global des dépenses directes et indirectes, celui directement affecté au service des urgences (hors UHCD) et les dépenses induites par le recours au plateau technique. Des commissions d'établissement telles que celle des admissions non programmées (commission des admissions et des consultations non programmées [CACNP]) et de la permanence des soins (commission de l’organisation de la permanence des soins [COPS]) analysent ces indicateurs.
Les buts principaux visés par le recensement de ces marqueurs au sein des hôpitaux sont, au-delà de l’organisation, de définir le codage des actes et des diagnostics selon le thésaurus de la SFMU. Il en découle également un budget de service et des coûts dépassant la seule dépense par poste et par consommation. Il fait l’objet d'une procédure de facturation pour chaque passage, pour chaque malade non hospitalisé et pour les demandes de soins non programmés (DSNP) internes à l’hospitalisation en cas d'urgence vitale. Ce référentiel dessine les modalités :
- –
de tri et d'orientation à l’arrivée des patients ;
- –
de l’individualisation du flux pédiatrique ;
- –
de l’information des patients et des familles ;
- –
de l’amélioration de la relation de tous les acteurs de l’urgence (pompiers, police, gendarmerie, médecins libéraux, SAMU-SMUR).
C’est dans ce contexte que la spécificité de l’ophtalmologie s’impose par l’instauration d'un lien aisé soit par une ligne téléphonique d'accès direct dédiée, soit par la constitution d'une astreinte propre, voire la réunion des deux, assurant de joindre le consultant spécialiste à toute heure.
La communication avec les médecins est également encadrée. Elle oblige à la rédaction d'un courrier adressé au médecin traitant, que le patient soit ou non hospitalisé, et d'un courrier remis au patient à sa sortie avec si besoin copie des examens paracliniques réalisés. Les caractéristiques du dossier patient ont été également définies. Il doit y figurer en plus de l’observation médicale le numéro d'identification permettant la traçabilité du malade et l’analyse de l’évaluation bénéfice-risque.
La stratégie d'accréditation devenue obligatoire dans tous les centres de soins accorde une grande place aux services d'urgence. En effet, la procédure prend en considération le fonctionnement du service, son environnement incluant la disponibilité et la compétence des consultants, la liaison avec le plateau technique et la gestion des flux des malades et donc l’organisation de la filière de soins. L’entité « structure d'urgence » (SU), ancien service d'accueil des urgences, devient un service central dans un hôpital. Bon nombre de centres se sont engagés dans une démarche qualité et inscrits dans un projet d'assurance qualité (PAQ) contractualisé par la direction des hôpitaux et, à l’époque, l’Agence nationale d'accréditation et d'évaluation en santé (ANAES) [9]. Des indicateurs ont été définis, destinés à mesurer le degré de satisfaction des usagers, le délai d'attente et de prise en charge par une SU (encadré 2-1-2). De règle à l’échelle des centres hospitaliers, une SU générale est organisée, qui assure un accueil polyvalent avec si besoin une orientation secondaire des patients vers les services de spécialité, dont l’ophtalmologie. En cas d'organisation des établissements en multi-sites (voir chapitre 2.5.1 ), et dans un souci de non-perte de chance des patients dans leurs délais de pris en charge, il est possible de créer une SU spécifique d'ophtalmologie qui détourne directement les urgences oculaires vers le service dédié. La mise en place d'une telle antenne accordée par l’ARS exige une activité suffisante et la démonstration d'une économie réalisée dans le parcours patient en termes temporels, géographiques et financiers. Ainsi, le CHU de Brest a fait reconnaître une SU d'ophtalmologie avec unité de lieu, capacité d'accueil 24 heures/24 et d'hospitalisation, et financement propre.
Encadré 2-1-2
-
Nombre de patients admis (hospitalisés) en ophtalmologie
-
Nombre de patients opérés d'une chirurgie ophtalmologique provenant de la SU
-
Pourcentage de malades opérés/nombre de patients admis en permanence des soins en nuit profonde
-
Taux d'occupation des blocs par tranche horaire
-
Nombre de refus, et nombre de refus avec motifs discordants
-
Liste des motifs de refus
-
Nombre de signalements de fonctionnement non conforme
-
Nombre de retours après plus de 24 heures
-
Nombre d'aller-retour pendant la nuit profonde
-
Délai entre l’heure d'arrivée dans l’établissement d'origine et l’heure d'admission dans l’établissement missionné PDSES
-
Activité de la SU (passages, actes techniques médicaux, actes de petite chirurgie)
-
Aller-retour sans prise en charge chirurgicale adaptée
-
Délai d'accès à l’équipe chirurgicale jugé trop long
-
Immobilisation de l’équipe SMUR pour surveillance dans établissement
-
Immobilisation transport sanitaire pour surveillance dans établissement
-
Patient non pris en charge par l’équipe chirurgicale
-
Délai d'accès au bloc jugé trop long
-
Transfert injustifié
-
Transfert en dehors des horaires PDSES
-
Délai d'exploration diagnostique avant transfert jugé trop long
-
Délai de transfert jugé trop long
Deux approches de la qualité coexistent en matière de prise en charge des DSNP hors structure d'urgence, selon qu’elle émane du patient ou du soignant. Ces approches sont parfois contradictoires.
Du point de vue de l’usager (population) et du patient (individu), les urgences ophtalmologiques devraient satisfaire sans délai une demande de soins lorsqu’elle ne peut être satisfaite dans les meilleurs délais de consultation possibles, ceci avec le moins d'attente possible et dans les meilleurs standards de qualité (tableau 2-1-3). Il importe pour le patient que sa problématique de santé qu’il juge urgente soit prise en charge sans délai, à tout moment, par un professionnel de santé compétent en ophtalmologie. Il souhaite avoir accès à des soins d'urgence au tarif opposable de la Sécurité sociale. Le système de soins en ophtalmologie devrait donc être organisé en fonction de ces critères.
| Usager potentiel | Patient | Ophtalmologiste | |
|---|---|---|---|
| Disponibilité | Permanente | Immédiate | Compatible avec l'activité |
| Standard du soin | Homogène, constant | Global | Précis, focal |
| Qualité du triage | Haute VPP | Haute VPN | Haute sensibilité |
| Recours au soin | Suffisant | Illimité, récurent | Adapté, adéquat, parcimonieux |
| Accès au soin | Illimité | Non restreint | Compatible avec la qualité |
| Acteur de santé | Réseau pluriprofessionnel | Ophtalmologiste | Délégation de tâche maîtrisée |
| Technicité | Niveau opposable | Optimale | Requise, disponible |
| Coût du soin | Encadré | Au tarif opposable | Reconnu, rémunéré |
| Organisation | Protocolisée | Transparente, fonctionnelle | En réseau de soins |
| Temps d'attente | < 4 heures | Aucun | Adapté au flux et à la SU |
* Sensibilité du soin d'urgence = ne pas considérer non urgente une demande de soin non programmé qui le serait. Valeur prédictive positive (VPP) du soin d'urgence = reconnaître comme urgente une demande de soin non programmé qui le serait. Valeur prédictive négative (VPN) du soin d'urgence = reconnaître comme non urgente seulement les demandes de soins non programmés qui ne le sont réellement pas.
Pour un professionnel de santé oculaire, la qualité du soin est primordiale, déontologique. Il importe que tous les patients qui nécessitent un soin non programmé puissent être pris en charge dans des conditions optimales. De son point de vue habituel, il est préférable d'orienter un patient, plutôt que de mal prendre en charge une urgence par manque de disponibilité, et d'en altérer son pronostic. Puisque l’offre de soins se limite quand la technicité s’élève, le recours à un ophtalmologiste devrait être ciblé, voire modulé en collaboration avec les autres professionnels en délégation de tâche organisée. En outre, d'un point de vue professionnel, la responsabilité d'une prise en charge non programmée et/ou déléguée mérite d'être considérée par les tutelles et justement valorisée.
Malgré une volonté convergente des patients et professionnels d'ophtalmologie d'obtenir des soins ophtalmologiques adaptés, on devine que les moyens et les méthodes idéales pour y arriver peuvent en revanche diverger sur certains aspects (tableau 2-1-3).
L’autarcie relative de l’ophtalmologie et ses impératifs spécifiques de fonctionnement expliquent qu’en matière d'urgence, des organisations ou des structures dédiées à l’urgence ophtalmologique se soient développées. Pour autant, l’organisation et les critères de qualité de ces structures d'urgence restent assez proches de ceux des urgences générales. Un cahier des charges précis des tutelles permet d'appréhender le standard de qualité demandé actuellement à une structure d'urgence dédiée à l’ophtalmologie, offrant une permanence de soins de nuit profonde. On imagine aisément que les points abordés peuvent être transposables à toute la permanence des soins en ophtalmologie et au-delà.
[1] Loi no 2009‑879 du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires.
[2] ARS Île-de-France. Cahier des charges contractuel dans le cadre de la permanence des soins en établissement de santé (PDSES). En ligne :http://www.sante-iledefrance.fr/ PDSES/CDC__PDSES_chirurgie_ophtalmologie.pdf
[3] ARS Île-de-France. Cahier des charges contractuel dans le cadre de la permanence des soins en établissement de santé (PDSES). En ligne : http://www.sante-iledefrance.fr/ PDSES/CDC__PDSES_chirurgie_ophtalmologie.pdf
[4] DREES. Les établissements de santé. Édition 2016. En ligne : http://drees.social-sante. gouv.fr/IMG/pdf/pano-etab-sante-2016.pdf
[5] ARS. Typologie des urgences en ophtalmologie. Rapport d’expertise PDSES en ophtalmologie. 2012. En ligne : http://www.sante-iledefrance.fr/PDSES/Typologie_des_ urgences_ophtalmologiques.pdf
[6] Rigal-Sastourné JC. Rapport d’expertise PSDES nuit profonde en ophtalmologie. 2012. En ligne : http://www.sante-iledefrance.fr/PDSES/RAPPORT_OPHTALMO_PDSES.pdf
[7] Weber M, Cohen SY, Tadayoni R, et al. Évolution des pratiques pour la réalisation des injections intravitréennes. J Fr Ophtalmol 2008 ; 31 : 625-9.
[8] Nemitz B, Carli P, Carpentier F, et al. Référentiel métier-compétences pour la spécialité de médecine d’urgence. Annales françaises de médecine d’urgence 2012 ; 2 : 125-38.
[9] Felten E. Mise en place d’une démarche qualité au service d’accueil des urgences du CHU de nancy [thèse de doctorat en médecine]. Nancy : université Henri-Poincaré ; 2001.
Recensement des urgences ophtalmologiques en France
J. -L. BOURGES, J. -B. ROTTIER
-
On observe une augmentation de 4 à 6 % par an des passages en structure d'urgence ophtalmologique.
-
Le nombre de demandes de soins non programmés en ophtalmologie (DSNPO) prises en charge est estimé entre 575 000 et 590 000 par an pour les établissements de santé et autour de 600 000 par an pour l’ophtalmologie libérale.
-
Les médecins généralistes absorbent plus de 3 millions par an de DSNPO.
-
Les officines pharmaceutiques absorberaient plus de 5 millions par an de DSNPO.
Le dernier rapport de la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES) recensait 19,7 millions/an de passages aux urgences en France métropolitaine et départements et régions d'outre-mer (DROM), auprès des 723 structures d'urgence, situées dans 643 établissements de santé [1]. Il y est mentionné que les trois quarts des structures d'urgence (SU) relèvent du secteur public, et un quart des secteurs à but lucratif (cliniques pour 4/5e) ou non lucratif (participant au service public pour 1/5 e). Les établissements de santé observent une augmentation des passages en SU de 2,5 à 5 % par an [2, 3], tous motifs confondus. Cela se vérifie aussi en ophtalmologie (fig. 2-2-1). L’évolution des passages y est en hausse constante quasi linéaire d'environ 4 % par an depuis 1996. Elle se vérifie aussi hors de nos frontières. À Londres, les urgences ophtalmologiques n’ont cessé de croître depuis 10 ans, avec notamment un doublement des urgences post-traumatiques [4].
Parmi ces urgences, combien y a-t-il de demandes de soins non programmés en ophtalmologie (DSNPO) en France chaque année ? Leur recensement ne peut être qu’approximatif aujourd'hui. D’après l’enquête annuelle de la DREES, elles représentent entre 1 et 3 % des urgences totales en France (fig. 2-2-2) [5]. On observe une proportion similaire chez nos voisins britanniques [6, 7].
(Source : DRESS, juin 2015.)
Ces DSNPO sont adressées aux différents acteurs de santé : le corps infirmier, les pharmaciens, les médecins généralistes et les ophtalmologistes. Elles sont donc orientées vers les officines de pharmacie, les cabinets libéraux, les maisons de santé, les centres de soins, les établissements de santé privés ou publics, généraux ou universitaires.
Afin de tenter une estimation plus précise de la demande française de soins non programmés en ophtalmologie de ville, nous avons réalisé plusieurs enquêtes. Leurs méthodologies et les données recueillies sont détaillées dans le chapitre 2.4. Nous avons ciblé un territoire type et ses pharmacies, médecins généralistes, ophtalmologistes libéraux ainsi que ses groupements sanitaires territoriaux de permanence de soins. À chaque fois que cela était possible, nous avons croisé les informations recueillies avec les autres données sanitaires disponibles.
Nous avons mené une enquête en 2017 auprès des services ophtalmologiques de tous les centres hospitaliers universitaires (CHU) de France métropolitaine et DROM [8]. L’intégralité des CHU ont répondu via leurs chefs de service d'ophtalmologie. Nous avons pu dénombrer 398 650 passages par les SU des CHU, motivés par des DSNPO. En Île-de-France, le rapport de l’Agence régionale de santé (ARS) de 2012 évaluait à au moins 100 000 consultations/an le nombre d'urgences en ophtalmologie [2]. Environ 1 malade sur 10 consulterait en nuit profonde entre 22 heures 30 et 8 heures 30. Un travail collaboratif des trois principaux centres d'accueil des urgences ophtalmologiques de Paris intra-muros a montré qu’en 14 jours consécutifs, en 2017, ceux-ci recevaient 4 034 passages [9]. En 2016, ils ont accueilli 128 000 DSNPO. Par extrapolation, ces chiffres corroborent l’estimation antérieure de l’ARS avec une croissance d'un peu plus de 6 % par an. Ainsi, si l’on considère que la population d'Île-de-France représente 18 % de la population française métropolitaine et d'outre-mer (données INSEE2016), on extrapole qu’environ 575 000 DSNPO auraient transité par les principaux établissements de santé en France en 2016. Si l’on calcule que l’ophtalmologie représente 3 % des 19,7 millions d'urgences recensées par la DRESS en 2016, on obtient une estimation d'environ 590 000 DSNPO. Ce recoupement consolide notre estimation. Ce volume est en augmentation continue.
La proportion des motifs de consultation ophtalmologiques sans rendez-vous chez le médecin généraliste serait d'environ 1,23 %. Les acteurs omnipraticiens libéraux absorberaient donc chacun en moyenne autour de deux à trois DSNP par semaine pour des motifs ophtalmologiques présentés comme urgents. Cela permet d'estimer à environ 3 millions par an le nombre de ces consultations urgentes généralistes à motif ophtalmologique.
Le praticien ophtalmologiste de ville a reçu en 2017 en moyenne de routine environ 3 % de DSNP à caractère urgent. Rapporté au nombre d'ophtalmologistes libéraux exerçant, on peut estimer que le volume de ces consultations serait d'environ 660 000 par an en 2017.
Au total, les DSNP à caractère urgent en ophtalmologie prise en charge par ces différents acteurs médicalisés de santé auraient été en 2016 d'environ 4,3 millions.
En marge des prises en charges médicalisées, on considère que les officines de pharmacie formulent entre cinq et sept avis ophtalmologiques par semaine à caractère urgent. Il faut donc ajouter plus de 5 millions par an d'avis ophtalmologiques à caractère urgent pris en charge par les pharmaciens.
Un nombre inestimable de patients, au premier rang desquels se trouvent les patients-médecins, présentent un jour un item ophtalmologique qui pourrait être une urgence ophtalmologique mais qu’ils négligent ou automédiquent. Pour peu que les choses rentrent dans l’ordre et guérissent ou consolident ainsi, leur affection ne sera jamais recensée.
Au total, l’estimation globale porterait à un peu moins de 10 millions le nombre de consultants pour une DSNPO recensés ou estimés en 2016 en France métropolitaine et d'outre-mer (fig. 2-2-3).
On observe une croissance quasi linéaire de la fréquentation des structures d'urgence en ophtalmologie. Cette tendance à la hausse naît de facteurs plus conjoncturels qu’épidémiologiques. Il semble par exemple qu’une partie des patients qui éprouvent des difficultés à obtenir un rendez-vous d'ophtalmologie pour une DSNPO consultent in fine dans les SU des établissements de santé. La prise en charge sociale et l’accessibilité aux soins sont aussi probablement des facteurs d'influence (voir chapitre 1.2 ). Les DSNPO pouvant se reporter d'un acteur de santé vers un autre, la tendance évolutive globale des DSNPO n’est pas connue à ce jour : rien n’indique formellement qu’elle augmente comme celle des SU.
[1] direction des études de l’évaluation et des statistiques D. Les établissements de santéÉdition 2016. Les établissements de santé [Internet]. 2016 01/06/2017. Available from: http://drees.social-sante.gouv.fr/IMG/pdf/pano-etab-sante-2016.pdf.
[2] Rigal-Sastourné JC. Rapport d’expertise PSDES nuit profonde en ophtalmologie. 2012. En ligne : http://www.sante-iledefrance.fr/PDSES/RAPPORT_OPHTALMO_ PDSES.pdf
[3] Berchet C. Emergency care services : trends, drivers and interventions to manage the demand. Paris : OECD Publishing ; 2015.
[4] MacEwen C, Buchan J. The way forward : options to help meet demand for the current and future care of patients with eye disease. En ligne : https://www.rcophth.ac.uk/ wp-content/uploads/2015/10/RCOphth-The-Way-Forward-Glaucoma-300117.pdf.
[5] Mauro L, Vertueux G. Résultats de l’enquête nationale auprès des structures des urgences hospitalières. Actes du colloque du 18 novembre 2014. Dossiers Solidarité et Santé no 63, juin 2015. En ligne : http://drees.social-sante.gouv.fr/IMG/pdf/dss63.pdf
[6] England NHS. Transforming urgent and emergency care services in England. Urgent and emergency care review end of phase. 2013. En ligne :https://www.england.nhs.uk/ wp-content/uploads/2015/06/trans-uec.pdf
[7] Sheldrick J, Wilson A, Vernon S, Sheldrick C. Management of ophthalmic disease in general practice. Br J Gen Pract 1993 ; 43(376) : 459‑62.
[8] Bourges JL. Urgences ophtalmologiques dans les centres hospitaliers universitaires français. J Fr Ophtalmol 2018 ; sous presse.
[9] Pison AD, S. Pierru, A. Tuil, et al. Épidémiologie des urgences ophtalmologiques parisiennes : une étude multicentrique. 123e Congrès de la Société française d’ophtalmologie – 6 mai 2017.
Épidémiologie des items urgence
A. PISON, C. VIGNAL- CLERMONT, A. PIERRU, S. DERRIEN, J. -L. BOURGES
-
L’incidence des demandes de soins non programmés ophtalmologiques a tendance à augmenter depuis une dizaine d'années dans les structures d'urgence.
-
La nature des demandes de soins non programmés ophtalmologiques est d'une grande variété avec un large spectre d'items d'urgence (pathologies rencontrées aux urgences).
-
Un faible pourcentage des items pris en charge en structure d'urgence nécessite une prise en charge sans délai en raison d'une menace visuelle imminente.
-
Bien qu’elles soient très exceptionnelles, il existe des urgences vitales à point d'appel ophtalmologique.
Les urgences ophtalmologiques connaissent depuis quelques années une fréquentation grandissante. Cela nécessite d'adapter l’organisation de l’accueil d'urgence ophtalmologique au volume et à la gravité des pathologies présentées par les patients. Ainsi, le nombre de passages par an sur l’ensemble des trois structures d'urgence ophtalmologique (SUO) parisiennes en témoigne : il est passé de 78 000 à 120 000 entre 2010 et 2015 [1], augmentant de près de 54 %, puis à 128 000 en 2016.
Parmi les demandes de soins non programmées (DSNP), la part de consultations liées à un problème ophtalmologique n’est pas négligeable. En effet, la fréquence des urgences ophtalmologiques par rapport aux urgences générales varie de 1 à 5 % en France [2–6], de 1,46 à 6,1 % au Royaume-Uni [7, 8] et de 1,5 à 2,6 % aux États-Unis [9, 10].
L’incidence des demandes de soins non programmées ophtalmologiques (DSNPO) varie selon les pays et la manière dont les informations ont été recueillies dans les études.
Après avoir détaillé la prévalence et l’incidence des DSNPO, nous proposerons un profil des items d'urgence ophtalmologiques en structure d'urgence ophtalmologique dédié et en structure d'urgence générale.
L’incidence des items d'urgences ophtalmologiques a fait l’objet de peu de publications. Elle varie selon les pays (tableau 2-3-1).
| France | |||||
| Caractéristiques | Girard [2] | Jeannin [3] | Personnelle | ||
| Période concernée | 1989-2000 | 2014 | 2016 | ||
| Incidence | 5,1 pour 1 000 habitants | − | 5,8 pour 100 habitants | ||
| Pourcentage de consultations pour motif oculaire | 5 % | 2 % | − | ||
| États-Unis | |||||
| Caractéristiques | Nash [9] | Vaziri [10] | Channa [12] | Stagg [11] | |
| Période concernée | 1993 | 2010 | 2006-2011 | 2001-2014 | |
| Incidence | 9,7 pour 1 000 habitants | 647 pour 10 000 habitants | 636 pour 100 000 habitants | − | |
| Pourcentage de consultations pour motif oculaire | 2,6 % | 1,5 % | − | 3,4 % | |
| Royaume-Uni | |||||
| Caractéristiques | Edwards [8] | Bhopal [15] | Flitcroft [16] | Sheldrick [14] | Smith [13] |
| Période concernée | 1987 | 1989 | 1995 | 1992 | 2010-2011 |
| Incidence | − | 2,64 pour 1 000 habitants | − | 71,8 pour 1 000 habitants/an | Augmentation de 7,9 % des passages par an au Moorfields |
| Pourcentage de consultations pour motif oculaire | 6,1 % | − | 1,46 à 6,1 % | − | − |
En banlieue parisienne, la prévalence des urgences ophtalmologiques en période de permanence de soins des établissements de santé (PDSES) représenterait 5,1 pour 1 000 habitants pour une population de 245 400 habitants [2]. En 2016, 128 000 passages en SUO ont été recensés dans Paris, soit 5,8 pour 100 habitants. Il s’agit de DSNPO accueillis 24 heures/24, 7 jours/7. Cela signifie qu’en additionnant leur accueil en continuité des soins et celui en PDSES, les DSNPO totales représenteraient probablement un volume 10 fois plus important que celui seulement vu en horaires de PDSES. Sur le territoire français, on estime qu’environ 6,5 % de la population est médicalisée chaque année pour une DSNPO. Un Français (de métropole ou d'outre-mer) sur cent a recours chaque année à une structure d'urgence (SU) pour une DSNPO (voir chapitre 2.2).
Aux États-Unis, plusieurs études épidémiologiques de grande ampleur ont été réalisées sur les urgences. Les caractéristiques pour les items d'urgence ophtalmologiques y sont précisées.
Entre 2001 et 2014, l’incidence des DSNPO (étude sur plus de 370 000 passages) par rapport aux DSNP totales était de 3,4 % [11]. En 2010, un échantillon représentatif de la population ( nationwide emergency department sample [NEDS]) permettait d'estimer cette incidence à 1,5 % de la population [10]. La prévalence était estimée entre 6,47 et 9,7 pour 1 000 habitants [10, 11] à partir de données collectées sur 6 ans (entre 2006 et 2011). Dans cette période, la prévalence estimée des consultations aurait diminué de 722 à 636 pour 100 000 habitants [12].
Au Royaume-Uni, sur les 30 649 passages annuels aux urgences d'un hôpital généraliste, 6,1 % (n = 1870) étaient liés à un problème oculaire [8]. À Londres, l’incidence des urgences augmente chaque année de plus de 7,9 % depuis 2008 [13]. La prévalence variait entre 2,64 et 71,8 pour 1 000 habitants à la fin du XX e siècle [14, 15]. Cette amplitude étendue rend difficile l’analyse évolutive de l’incidence. Les chiffres actuels semblent compris dans cette amplitude [13].
Les DSNPO représenteraient 1,46 à 6 % des passages aux urgences totaux [7, 8, 16, 17]. Parmi celles-ci, 51 à 65,6 % seraient liées à un traumatisme oculaire [8, 16, 18] et 27 % à une inflammation ou une infection [7, 8, 16]. Les médecins généralistes britanniques recevraient entre 1,5 et 2 % de DSNPO lors de leurs consultations [6, 14].
Le pourcentage d'hommes consultant en SUO pour un item oculaire est généralement supérieur à celui des femmes, soit 52 % en 2016 en France, entre 53 et 60 % aux États-Unis [10–12, 19] et 67,2 % en Royaume-Uni [15]. Pour les traumatismes, la proportion d'hommes monte entre 73 et 84 % des cas [15].
L’âge moyen des patients consultant aux urgences pour motif oculaire semble relativement homogène dans les études, oscillant entre la troisième et la quatrième décennie :
- –
en France, un pic de fréquence à 43 % a été retrouvé chez les 18-40 ans entre 1989 et 2000 [2]. Sur les trois centres parisiens, la moyenne d'âge était de 45 ans en 2016 ;
- –
aux États-Unis, il varie entre 31 et 47,4 ans [10–12] ;
- –
au Royaume-Uni, il varie entre 34 et 41 ans [14–16].
La nature et la survenue des items d'urgence ophtalmologiques peuvent être approchées par les quelques rares travaux disponibles dans la littérature scientifique (tableau 2-3-2). Afin de préciser et d'actualiser ces informations, nous avons réalisé en 2016 un recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes (OphtalmoPôle de Paris, Fondation ophtalmologique Adolphe de Rothschild et centre national d'ophtalmologie des Quinze-Vingts) sur une période de 15 jours consécutifs.
| France | États-Unis | Royaume-Uni | Irlande | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Caractéristiques | Girard [2] | Jeannin [3] | Pison | Nash [9] | Vazir [10] | Sridhar [23] | Channa [12] | Cheung [19] | Stagg [11] | Chiapella [22] | Edwards [8] | Bhopal [15] | Flitcroft [16] | Sheldrick [14] | Vartsakis [24] | |
| Période concernée | 1989-2000 | 2014 | 2016 | 1993 | 2010 | 2010-2014 | 2006-2011 | 2007-2010 | 2001-2014 | 1981-1982 | 1987 | 1989 | 1995 | 1992 | − | |
| Âge moyen en années (± écart type quand disponible) | − | < 36 ans pour 45 % des patients | 45 | − | 42,8 | − | 31 (22) | − | 47,4 (15,1) | 23 | − | 41 | A&E Dep.:
|
| − | |
| Pourcentage d'hommes ou ratio H/F | Ratio 1,88 | 68 % | 52 % | − | 53,20 % | − | 54,20 % | 60 % | 56,60 % | 71 | 3:1 |
|
| − | − | |
| Pourcentage de prise en charge médicale versus chirurgicale | 65/35 | − | 57/43 | − | − | − | − | 54/39,4 | − | − | − | − | − | − | − | |
| Pourcentage de patients urgents versus non urgents | − | − | − | − | − | 65/35 | 41,2/44,3 | − | 23,4/76,6 | − | − | − | − | − | − | |
| Diagnostics | ||||||||||||||||
| Traumatologie | 54,70 % | 53 % | 15 % | 49 % (dont 2/3 hommes) | 34 % | − | − | 48,3 % | − | 52 % | 65,6 % | 44 % | A&E Dep.: | CO: | − | 31,9 % |
| 51 % | 24 % | |||||||||||||||
| Conjonctivites | − | − | 22 % | − | 33,80 % | Virale 8,7 % | 28 % | 69,60 % (NU) | − | − | − | − | − | 33,60 % | − | |
| Inflammation | 12,60 % | 33 % | − | − | − | − | − | − | − | − | 21,7 % | 32,30 % | 8 % | 14 % | − | 33 % |
| Infection | 20 % | − | − | − | − | − | − | 8 % | − | − | − | 27 % | 26 % | − | − | |
| Autres | 0,8 % neuro-ophtalmologie | 16 % |
| − |
|
|
|
|
| 29 % infection/inflammation | 23,60 % | 7 % | 16 % | − |
| |
Entre 1989 et 2000 [2], 55 % des items étaient traumatiques. On observait que 95 % des patients s’agrégeaient sur seulement 23 items d'urgence différents. Les items ophtalmologiques d'urgence étudiés avaient été divisés en deux catégories : items traumatiques et items d'urgence médicaux.
La pathologie traumatique consistait en : 35,3 % de plaies de cornée ; 10 % de traumatismes de l’orbite ; 6 à 10 % de plaies conjonctivales ; 2 % d'hyphémas ; 2 % de traumatismes de paupières ; et 1 % de plaies perforantes du globe.
Les pathologies médicales se répartissaient entre les pathologies infectieuses (15,2 %) – dont 11 % de conjonctivites infectieuses, 2,5 % de kératites superficielles, 1 % d'abcès cornéens, 0,54 % de dacryocystites et 0,18 % d'herpès – et les pathologies inflammatoires (12,6 %) – dont 6,3 % de conjonctivites allergiques, 4 % de pathologies touchant les paupières, 1,25 % d'uvéites, 1,05 % de sclérites/épisclérites.
L’étude que nous avons réalisée pour ce rapport en 2016 sur les trois SUO parisiennes a retrouvé un spectre très étendu concernant la nature des items d'urgence identifiés. La majorité des items avaient une proportion inférieure à 5 % du total des items (fig. 2-3-1). En 15 jours seulement, plus de 80 items de nature différente ont été diagnostiqués. Si quelques rares items d'urgence ophtalmiques peuvent engager immédiatement le pronostic vital, nous n’en avons pas relevé au cours des 15 jours de notre étude.
La proportion des traumatismes était plus faible que dans les autres études (16 %). Données d'analyse issues du recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes sur une période de 15 jours consécutifs en 2016 (n = 4632, diagnostic formel n = 3709).
La figure 2-3-2 représente la proportion des items d'urgence ophtalmologiques tels que le diagnostic des praticiens les a identifiés, par ordre décroissant. Évidemment, plusieurs items pouvaient être identifiés au cours d'une même DSNPO. On remarque que les conjonctivites représentent la plus grande proportion des items, mais la majorité des items se répartissent dans la tranche des pourcentages inférieurs à 5 %. Leur nature est très variée.
Les pourcentages ont été calculés sur l’échantillon de population pour lequel un diagnostic formel était identifiable (n = 3709). Données d'analyse issues du recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes sur une période de 15 jours consécutifs en 2016.
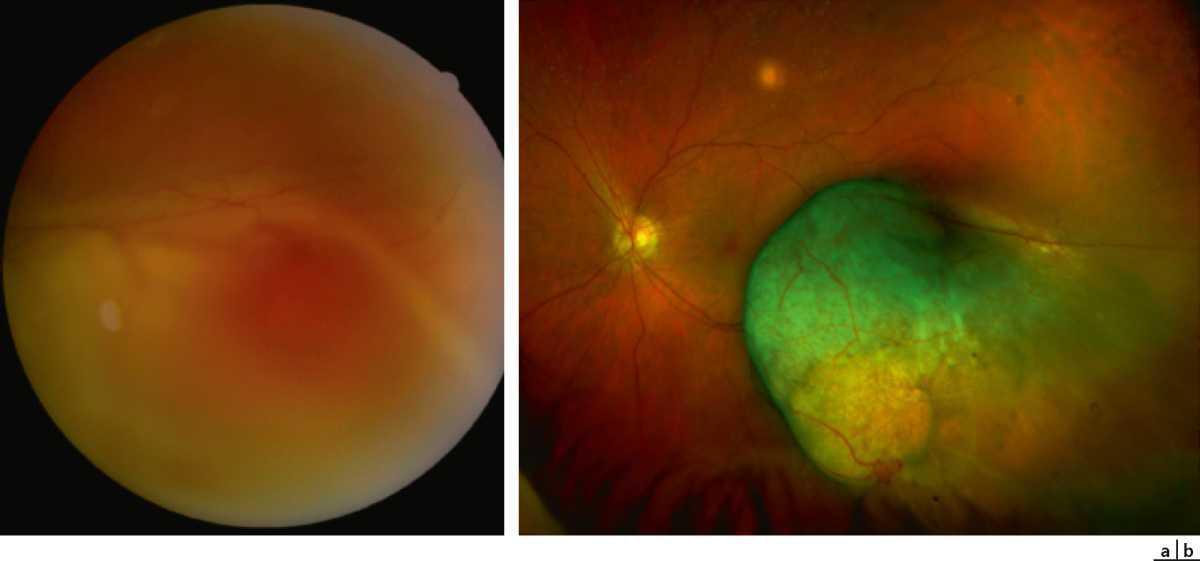
Les figures 2-3-3 à 2-3-5 illustrent quelques diagnostics fréquents et/ou graves qui peuvent être vus aux urgences ophtalmologiques, on a noté ainsi comme fréquent mais non grave, le chalazion (fig. 2-3-3), et comme peu fréquents mais graves, la plaie de cornée (fig. 2-3-4) et le glaucome aigu par fermeture de l’angle (fig. 2-3-5).
Photographie à la lampe à fente.
Photographie à la lampe à fente.
Photographie à la lampe à fente.
Nous avons recensé 16 % de traumatismes, dont 60 % ont été pris en charge en horaires de PDSES (fig. 2-3-6). C’est moins qu’auparavant et que dans les autres études. Parmi les explications possibles, il peut exister un effet de recrutement citadin. Il se peut aussi que l’incidence des traumatismes ait réellement diminué. Enfin, il est probable que la prise en charge médicale de première ligne gère un nombre plus conséquent de traumatismes de manière autonome, avant le recours aux SUO. Les contusions orbitaires représentaient 35 % des items traumatiques devant les corps étrangers cornéens (fig. 2-3-4), les kératites ponctuées superficielles post-traumatiques et les ulcères cornéens (tableau 2-3-3). De nombreux items post-traumatiques représentaient moins de 1 pour 1000 du total des items. On citera par exemple les brûlures de cornée ou de paupière, les contusions cornéennes, les décollements de rétine, les hypertonies, les uvéites antérieures aiguës post-traumatiques.
La permanence des soins (PDS) reçoit, de 8 heures à 18 heures, les samedis, dimanches et jours fériés, 60 % des traumatismes oculaires et des annexes, dont un tiers le week-end. Données d'analyse issues du recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes sur une période de 15 jours consécutifs en 2016.
| Item identifié | n = | Proportion |
|---|---|---|
| Contusion orbitaire | 769 | 35,5 % |
| CE cornéen | 421 | 19,4 % |
| Kératite ponctuée superficielle | 356 | 16,4 % |
| Ulcère cornéen | 172 | 7,9 % |
| Contusion oculaire | 143 | 6,6 % |
| Hyperhémie conjonctivale isolée | 62 | 2,9 % |
| Contusion palpébrale | 41 | 1,9 % |
| Plaie pénétrante | 30 | 1,4 % |
| Hémorragie sous-conjonctivale | 29 | 1,3 % |
| Brûlure oculaire | 20 | 0,9 % |
| Kératite infectieuse | 16 | 0,7 % |
| Examen normal | 14 | 0,6 % |
| Plaie palpébrale | 11 | 0,5 % |
| CE conjonctival | 10 | 0,5 % |
| Hyphéma | 9 | 0,4 % |
| Plaie conjonctivale | 9 | 0,4 % |
| Hémorragie intravitréenne | 7 | 0,3 % |
| CE sous-palpébral | 4 | 0,2 % |
| Contrôle post-traumatique | 4 | 0,2 % |
| Hématome péri-orbitaire | 4 | 0,2 % |
| Postopératoire | 4 | 0,2 % |
| Trouble visuel permanent | 4 | 0,2 % |
| CEIO | 3 | 0,1 % |
| Diplopie binoculaire | 3 | 0,1 % |
| Contusion rétinienne | 2 | 0,1 % |
| Déchirure rétinienne | 2 | 0,1 % |
| Douleur aiguë isolée | 2 | 0,1 % |
| Épisclérite/sclérite | 2 | 0,1 % |
| Fracture orbitaire | 2 | 0,1 % |
| Hémorragie rétinienne | 2 | 0,1 % |
| Parti sans consultation | 2 | 0,1 % |
* Les items représentant moins de 0,1 % ne sont pas rapportés. Données d'analyse issues du recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes sur une période de 15 jours consécutifs en 2016 (n = 4632). CE:corps étranger; CEIO:corps étranger intra-oculaire.
En fonction du diagnostic évoqué, nous avons pu estimer la sévérité des items, selon l’échelle quantitative du BAsic SEverity Score for Common OculaR Emergencies (BaSe SCOrE) [20]. On remarque que la majorité des items (68 %) se situe dans les catégories de sévérité 1 et 2 (fig. 2-3-7), les pathologies de sévérité importante (4 ou 5) représentant 10,7 % des patients.
Données d'analyse pour lequel un diagnostic formel était identifiable (n = 3709) issues du recueil de données homogènes sur les passages d'urgence dans les trois SUO parisiennes sur une période de 15 jours consécutifs en 2016.
Les études réalisées aux États-Unis ont utilisé la base de données NEDS. Elles identifiaient les items ophtalmologiques à l’aide de la classification ICD-9 (International classification of diseases, 9 th revision). Ainsi, en 2010, les items les plus fréquemment retrouvés étaient les conjonctivites (33,8 %), l’érosion cornéenne sans corps étranger (13,1 %), le corps étranger cornéen (7,8 %), les douleurs oculaires (4,2 %), l’orgelet (4,0 %). La DSNPO était motivée par un traumatisme dans 34 % des cas [10].
Sur 6 ans de 2006 à 2011 [12], plus de 4 millions des items identifiés suite à une DSNPO étaient considérés sans urgence évidente : conjonctivite, hémorragie sous-conjonctivale ou orgelet (tableau 2-3-4).
| Conjonctivite virale avec larmoiement clair et chémosis. | Items non immédiatement urgents:
|
| Contusion. | Items d'urgence relative:
|
| Exophtalmie avec diplopie récente d'origine encore indéterminée. | Items dont l'urgence n'était pas déterminée:
|
La prévalence des brûlures oculaires était de 28,61 et 23,49 pour 100 000 enfants de respectivement 1 et 2 ans. Entre 18 et 64 ans, elle était en moyenne de 13,28 pour 100 000 habitants [21]. L’incidence des traumatismes oculaires parmi tous les items d'urgence oculaires varie selon les études américaines entre 34 et 52 % [9, 10, 19, 22].
En 1989 déjà, une étude rapportait que dix items expliquaient 68 % des visites pour problème oculaire [15] : plaie de cornée (33 %), conjonctivite aiguë (12 %), kératite superficielle (7,8 %), plaie de conjonctive (6 %), uvéite (3,4 %), hémorragie sous-conjonctivale, plaie de paupière (4,2 %), conjonctivite chronique (2,2 %), ulcère de cornée (17,8 %) et chalazion. L’incidence des items traumatologiques varie selon les études entre 24 et 65 % [8, 14-16]. Une étude a comparé un centre d'urgence non ophtalmologique et un centre ophtalmologique [16]. Elle a identifié une incidence traumatique oculaire de 51 % dans le centre non ophtalmologique et de 24 % dans le centre ophtalmologique. Au Royaume-Uni, le recours sanitaire d'urgence de première disponibilité semble donc filtrer les items traumatiques d'ophtalmologie. Il les prend en charge de manière suffisamment autonome pour qu’une proportion moindre s’adresse aux structures d'urgence spécialisées.
La fréquence de patients considérés non urgents était de 35 % sur une étude réalisée entre 2010 et 2014 [23].
En Irlande, une étude effectuée en 2012, et publiée en 2014, a rapporté : 31,9 % d'items traumatiques et 33,3 % d'items inflammatoires dont 9,6 % d'uvéites antérieures ; 9,1 % d'abrasions cornéennes ; 2,2 % de kératites bactériennes ; 1 % de plaies du globe perforantes [24]. Cette étude rapportait plus d'items d'urgence sévères en permanence de soins, bien que la majorité des patients aient consulté dans les heures ouvrées de journée (76,5 %).
L’incidence des traumatismes oculaires était en 2012 de 88 pour 100 000 habitants par an, dont 80 % d'hommes et 34 % d'accidents du travail [25].
La proportion des traumatismes oculaires était en 2011 de 41 % parmi les items d'urgence, avec un âge moyen de 59,7 ans (± 9,9 ans) et 49,4 % d'hommes, entraînant 20,3 % d'hospitalisations [26].
L’incidence et la prévalence des DSNPO démontrent qu’il s’agit d'un sujet de santé publique de premier plan, que ce soit en France ou à l’étranger. L’étude épidémiologique des items d'urgences ophtalmologiques objective la conjonctivite comme majoritaire parmi les DSNPO. Les items traumatiques restent aussi un premier plan. Environ un tiers des items d'urgence oculaires ont une origine traumatique. Cela met en évidence que les efforts de prévention et de protection oculaire des populations restent encore perfectibles. L’analyse des items d'urgence ophtalmologique objective aussi leur spectre particulièrement étendu. Plus de la moitié des DSNPO sont motivées par des items dont la proportion totale est inférieure à 5 %. De fait, les quelques items d'urgence qui engagent très rapidement le pronostic fonctionnel ou vital sont rares. Leur identification rapide nécessite donc d'y être formé et entraîné. On peut estimer qu’en France, un tiers des items sont considérés comme ayant un niveau de sévérité significatif (score de sévérité > 3/6). Il est donc justifié de disposer d'un maillage territorial adapté à la prise en charge de toutes les DSNPO.
[1] Rigal-Sastourné JC. Rapport d’expertise PSDES nuit profonde en ophtalmologie. 2012. En ligne : http://www.sante-iledefrance.fr/PDSES/RAPPORT_OPHTALMO_PDSES.pdf
[2] Girard B, Bourcier F, Agdabede I, Laroche L. Activité et épidemiologie d’un centre d’urgence en ophtalmologie. J Fr Ophtalmol 2002 ; 25 : 701‑11.
[3] Jeannin A, Mortemousque B, Mouriaux F. Prise en charge des urgences ophtalmologiques en structure des urgences : étude multicentrique rétrospective. J Fr Ophtalmol 2016 ; 39 : 589‑95.
[4] Mauro L, Vertueux G. Résultats de l’enquête nationale auprès des structures des urgences hospitalières. Actes du colloque du 18 novembre 2014. Dossiers Solidarité et Santé no 63, juin 2015. En ligne :http://drees.social-sante.gouv.fr/IMG/pdf/dss63.pdf
[5] England NHS. Transforming urgent and emergency care services in England. Urgent and emergency care review end of phase. 2013. En ligne : https://www.england.nhs.uk/ wp-content/uploads/2015/06/trans-uec.pdf
[6] Sheldrick J, Wilson A, Vernon S, Sheldrick C. Management of ophthalmic disease in general practice. Br J Gen Pract 1993 ; 43(376) : 459‑62.
[7] Clancy M, Hulbert M. A study of the eye care provided by an accident and emergency department. Emergency Medicine Journal 1991 ; 8 : 122‑4.
[8] Edwards R. Ophthalmic emergencies in a district general hospital casualty department. British Journal of Ophthalmology 1987 ; 71 : 938‑42.
[9] Nash EA, Margo CE. Patterns of emergency department visits for disorders of the eye and ocular adnexa. Archives of Ophthalmology 1998 ; 116 : 1222‑6.
[10] Vaziri K, Schwartz SG, Flynn Jr HW, et al. Eye-related emergency department visits in the United States, 2010. Ophthalmology 2016 ; 123 : 917.
[11] Stagg BC, Shah MM, Talwar N, et al. Factors affecting visits to the emergency department for urgent and nonurgent ocular conditions. Ophthalmology 2017 ; 124 : 720‑9.
[12] Channa R, Zafar SN, Canner JK, et al. Epidemiology of eye-related emergency department visits. JAMA ophthalmology 2016 ; 134 : 312‑9.
[13] Smith R, Tromans C. Commissioning better eye care : urgent eye care. The Royal College of Ophthalmologists/College of Optometrists ; 2013. En ligne : https://www.rcophth. ac.uk/wp-content/uploads/2014/12/urgent-eye-care-template-25‑11‑13‑2013-_PROF_264.pdf
[14] Sheldrick J, Vernon S, Wilson A. Study of diagnostic accord between general practitioners and an ophthalmologist. BMJ 1992 ; 304 : 1096‑8.
[15] Bhopal R, Parkin D, Gillie R, Han K. Pattern of ophthalmological accidents and emergencies presenting to hospitals. Journal of Epidemiology & Community Health 1993 ; 47 : 382‑7.
[16] Flitcroft D, Westcott M, Wormald R, Touquet R. Who should see eye casualties ? A comparison of eye care in an accident and emergency department with a dedicated eye casualty. Emergency Medicine Journal 1995 ; 12 : 23‑7.
[17] Tan M, Driscoll P, Marsden J. Management of eye emergencies in the accident and emergency department by senior house officers : a national survey. Emergency Medicine Journal 1997 ; 14 : 157‑8.
[18] MacEwen CJ, Baines PS, Desai P. Eye injuries in children : the current picture. Br J Ophthalmol 1999 ; 83 : 933‑6.
[19] Cheung CA, Rogers-Martel M, Golas L, et al. Hospital-based ocular emergencies : epidemiology, treatment, and visual outcomes. Am J Emerg Med 2014 ; 32 : 221‑4.
[20] Bourges JL, Boutron I, Monnet D, Brezin AP. Consensus on Severity for Ocular Emergency : The BAsic SEverity Score for Common OculaR Emergencies [BaSe SCOrE]. J Ophthalmol 2015 ; 2015 : 576983.
[21] Haring RS, Sheffield ID, Channa R, et al. Epidemiologic trends of chemical ocular burns in the United States. JAMA ophthalmology 2016 ; 134 : 1119‑24.
[22] Chiapella A, Rosenthal A. One year in an eye casualty clinic. Br J Ophthalmol 1985 ; 69 : 865‑70.
[23] Sridhar J, Isom RF, Schiffman JC, et al. Utilization of ophthalmology-specific emergency department services. Seminars in ophthalmology. Taylor & Francis ; 2016.
[24] Vartsakis G, Fahy G. The profile of patients attending a triaged eye emergency service. Irish Journal of Medical Science 2014 ; 183 : 625‑8.
[25] Sahraravand A, Haavisto AK, Holopainen JM, Leivo T. Ocular traumas in working age adults in Finland – Helsinki Ocular Trauma Study. Acta Ophthalmologica 2017 ; 95 : 288‑94.
[26] Wong MY, Man RE, Gupta P, et al. Prevalence, subtypes, severity and determinants of ocular trauma: The Singapore Chinese Eye Study. Br J Ophthalmol 2017 ; pii : bjophthalmol- 2017‑310564.
L’urgence ophtalmologique en ville
J.-B. ROTTIER, V. COURRIÈRE, E. CAILLIEZ, J.-F. HUEZ, J. PENIT, I.-A. LECLAIR, A.-S. MICHENEAU, A. INGUERE
L’ophtalmologie fait partie des spécialités les plus exercées en libéral avec la gynécologie médicale, la dermatologie et la stomatologie. En effet, d'après le conseil national de l’Ordre des médecins, au 1 er janvier 2016, 64,1 % des ophtalmologistes exerçaient en libéral, 20 % de façon mixte (travail en libéral et salarié) et 15,9 % en tant que salariés [1]. Cet exercice libéral est réparti pour 47,5 % dans les cabinets individuels et pour 52,5 % dans des cabinets de groupe [2]. Il semble y avoir un mouvement de fond vers l’exercice libéral regroupé.
Bien que les structures d'urgences (SU) privées ne représentent que 23 % de la totalité des SU [3], une grande partie des actes de soins ophtalmologiques d'urgence se fait donc en libéral hors structure d'urgence.
Il serait faux de penser que l’ophtalmologiste est le seul acteur de l’urgence dans le secteur libéral. Deux autres groupes de professionnels gèrent de grands volumes de patients en urgence : les pharmaciens et les médecins généralistes.
À côté de ces derniers, les SU du secteur privé lucratif (anciennement appelées unités de proximité d'accueil, de traitement et d'orientation des urgences [UPATOU]) acceptent un flux d'urgence quantitativement plus modeste. Elles servent en général de filtre pour les ophtalmologistes libéraux qui se positionnent assez souvent en recours derrière elles.
Enfin, pour être exhaustif, il faut évoquer l’automédication qui est une réalité mal appréhendée. Une étude sur la question, faite par des internes de médecine générale qui l’analysent a posteriori, ainsi que sa méthodologie sont présentées ci-après.
Les SU hospitalières et des services hospitaliers d'ophtalmologie qui jouent le rôle de recours suprême ne sont pas évoqués dans ce sous-chapitre (voir chapitre 5.2.1). Ils peuvent être sollicités en premier recours. C’est une particularité de notre système que de permettre aux patients d'accéder directement au niveau d'expertise le plus élaboré.
En fait, le patient qui présente une symptomatologie ophtalmologique urgente et demande un soin non programmé (DSNP) a potentiellement plusieurs moyens d'accéder au soin.
Une étude des internes de médecine générale (voir paragraphe 2.4.3) offre un aperçu de la pratique d'automédication. Ainsi, avant de consulter leur médecin généraliste, 18 % des patients utilisent l’automédication. La fréquence de cette pratique augmente jusqu’à un tiers au-delà de 2 jours (fig. 2-4-1).
Les patients s’automédiquent principalement devant l’existence de sécrétions conjonctivales et, dans une moindre mesure, de douleurs ou d'une inflammation, mais beaucoup plus rarement pour des altérations visuelles (fig. 2-4-2).
L’automédication semble donc une pratique assez fréquente (21 %) avec une utilisation prédominante du lavage oculaire (fig. 2-4-3). L’utilisation d'antibiotiques et de produits associant antibiotique et corticoïde est surprenante : est-elle due à d'anciens produits gardés dans la pharmacie familiale ou à des produits délivrés en pharmacie ?
Le médecin généraliste doit adresser chez l’ophtalmologiste 6 % des patients ayant eu recours à l’automédication. L’automédication persistante n’est pas toujours pertinente : sur les sept cas documentés dans le relevé des internes de médecine générale, deux altérations de la vision existaient depuis plus de 1 mois.
Automédication face à la Symptomatologie d'urgence ocuiaire
-
Elle se pratique surtout en cas de sécrétions conjonctivales.
-
Un patient sur cinq a recours à l’automédication.
-
L’utilisation du lavage oculaire est prédominante.
Les pharmaciens sont souvent sollicités par les patients ayant une plainte oculaire. Pour avoir un aperçu de cette activité de réponse à l’urgence ophtalmologique, un questionnaire a été envoyé aux pharmacies de la Sarthe dans le cadre de ce rapport. Nous avons collecté 18 questionnaires correspondant à la gestion de 104 patients. Par ailleurs, le recueil des informations sur l’histoire du patient dans le cadre de l’étude des internes de médecine générale a permis d'analyser 59 situations dans lesquelles le pharmacien est intervenu en amont du médecin généraliste, soit 10 % des cas.
Globalement, le pharmacien traite plus qu’il n’adresse les demandes de soins non programmés d'ophtalmologie (DSNPO). La moyenne d'âge des patients pris en charge est de 31 ans et la médiane est de 32 ans. Le pharmacien prend en charge les urgences oculaires qui se présentent à lui, sans les adresser dans plus de trois quarts des cas. Il n’adresse donc qu’un quart de cette population (fig. 2-4-4).
Le pharmacien, en première ligne face à l’urgence ophtalmologique, traite plus qu’il n’adresse les patients.
La figure 2-4-4 rend compte de l’attitude du pharmacien analysée à partir de ses déclarations et a posteriori à partir du recueil du médecin généraliste. Le pharmacien adresse plus souvent les patients avec des troubles récents, inférieurs à 2 jours (fig. 2-4-5). Lorsque le pharmacien juge nécessaire que le patient voie directement le médecin généraliste, ce dernier pose l’indication d'une consultation en urgence avec l’ophtalmologiste dans 14 % des cas. Si on isole les patients qui ont été traités par le pharmacien, aucun d'entre eux n’a été envoyé secondairement par le généraliste à l’ophtalmologiste. L’attitude du pharmacien pour l’adressage des symptômes oculaires urgents semble donc globalement pertinente.
Chez les patients demandant un avis au pharmacien, l’œil rouge prédomine et les altérations de vision sont quasi absentes. Il semble que les femmes consultent plus le pharmacien en matière de symptomatologie oculaire d'urgence. Le recueil de données répertorie 59 % de femmes pour 41 % d'hommes (308 femmes sur 591 patients) qui demandent conseil aux pharmaciens.
Majoritairement, le pharmacien prend en charge les patients qui le sollicitent (fig. 2-4-6). L’inflammation est le symptôme le moins adressé. Il est intéressant de constater que les pharmaciens déclarent ne prendre en charge qu’environ 1 % des anomalies visuelles, alors que les médecins généralistes rapportent que les pharmaciens en traitent 14 %. On note que deux tiers à trois quarts de la symptomatologie d'urgence vue en première ligne par les pharmaciens font l’objet d'une prise en charge pharmacienne simple. Cela donne une idée du volume de la symptomatologie oculaire d'urgence qui n’est en réalité pas médicalisée en pratique courante.
Par rapport aux traitements d'automédication où le lavage simple prédomine, l’antiseptique est préféré (fig. 2-4-7). En revanche, les antalgiques, souvent pris en automédication, ne semblent pas proposés par le pharmacien. C’est une attitude prudente. En effet, si l’œil est réellement douloureux au point de nécessiter une antalgie, un avis médical est requis. On note un volume de dispensation non négligeable d'antibio-corticoïdes ou d'homéopathie dans la prise en charge non médicalisée d'une symptomatologie oculaire d'urgence de première ligne.
Au total, la plupart des patients demandant avis au pharmacien sont pris en charge par celui-ci : le pharmacien traite plus qu’il n’adresse. Il est bien sûr approximatif d'évaluer l’importance des flux à partir d'une unique collection de données. Concernant l’enquête qui a été conduite dans le département de la Sarthe, chaque pharmacie recevait en moyenne 5,83 patients par semaine, soit presque 1 par jour. Cette enquête retrouve les chiffres issus du travail fait en Bourgogne qui montrait que le pharmacien était amené à formuler en moyenne 7 avis ophtalmologiques par semaine [4]. Si on extrapolait ces données aux 22 094 officines pharmaceutiques en France métropolitaine et départements et régions d'outre-mer, on totaliserait 6,9 millions de personnes prises en charge pour une symptomatologie oculaire d'urgence dans les pharmacies sur une année. Nous retiendrons prudemment l’estimation de « plusieurs millions de patients » par an.
-
Les patients se présentent au pharmacien pour des troubles récents.
-
L’avis majoritaire est donné pour un œil rouge.
-
Selon les pharmaciens, ceux-ci ne prendraient en charge qu’environ 1 % des anomalies visuelles, tandis que les médecins généralistes estiment ce chiffre à 14 %.
-
La pharmacie adresse un patient sur sept à l’ophtalmologiste en urgence.
-
La pharmacie dispense préférentiellement des antiseptiques ; elle dispense régulièrement des antibio-corticoïdes ou de l’homéopathie.
-
Probablement plus de 5 millions de personnes sont prises en charge chaque année pour une symptomatologie oculaire d'urgence dans les pharmacies.
Les urgences ophtalmologiques constituent un groupe de pathologies variées que tout médecin généraliste rencontre dans son exercice quotidien. Leur prise en charge par un médecin généraliste est à la fois habituelle (démarche diagnostique fondée sur le recueil des signes fonctionnels et des signes d'examen) et particulière (examen effectué sans l’équipement spécialisé dont dispose l’ophtalmologiste). Elle nécessite un minimum de matériel et la connaissance de techniques d'examen aisément réalisables au cabinet médical.
En médecine générale, les consultations en ophtalmologie sont peu fréquentes, mais elles sont le plus souvent ressenties comme urgentes par le patient. De ce fait, le médecin généraliste doit mettre en place une prise en charge rapide et adaptée afin de résoudre les problèmes au plus vite.
Pour étayer notre propos, nous nous sommes appuyés sur deux enquêtes, l’une réalisée en 2008 par le docteur Courrière, l’autre effectuée en 2015-2016 par les auteurs de ce sous-chapitre.
La première étude a consisté en une enquête réalisée auprès de 90 médecins généralistes de Haute-Garonne [5]. Elle a permis d'analyser les 36 retours complets d'un questionnaire auto-administré sur l’ophtalmologie en pratique de médecine générale courante. Trois quarts des médecins généralistes exerçaient en milieu urbain et deux tiers avaient plus de 20 ans d'expérience.
La seconde étude a consisté en deux collections de données médicales réalisées par deux groupes d'internes de médecine générale de la faculté d'Angers. Les deux groupes étaient constitués respectivement de 24 et 28 internes lors de leur stage en autonomie supervisée chez des médecins généralistes maîtres de stage entre mai 2015 et avril 2016. En fin de consultation, une fiche d'observation était remplie lorsque la sphère oculaire avait été évoquée. Pour être en cohérence avec d'autres travaux, la classification internationale des soins primaires dans sa version 2 (CISP-2) a été utilisée. Ainsi, pendant 1 an, sur une base de 53 463 consultations, 674 motifs ophtalmologiques ont été répertoriés. Nous évoquons ici les résultats intermédiaires correspondant à 591 fiches renseignant un motif ophtalmologique.
On a constaté que les consultations d'ophtalmologie étaient peu fréquentes chez un médecin généraliste, évaluées entre une par journée de 30 patients en moyenne (étude Haute-Garonne) et une par semaine de travail (1,23 %, étude Angers). Le poids des motifs ophtalmologiques dans l’ensemble des motifs de consultation en médecine générale était donc faible. En banlieue parisienne, en service de garde, en horaires de nuit profonde, il semble qu’un médecin généraliste voit moins de 1 % d'urgence ophtalmologique, 2/3 d'urgence pédiatrique et 1/3 d'urgence adulte [6]. Lorsqu’elle existe, la symptomatologie oculaire constitue le motif principal de la consultation dans trois quarts des cas.
Ces données font prendre conscience du volume du flux massif de patients concernés. Un médecin généraliste réalise environ 3 800 consultations par an. Il est consulté en moyenne minimaliste par 38 patients relevant de l’ophtalmologie soit au minimum un par semaine de travail. Ces évaluations sont probablement inhomogènes et accentuées dans les territoires provinciaux où la ressource ophtalmologique serait déficitaire. Le nombre de consultations et de visites de médecine générale par an en France est de 259 millions (année 2014, source CNAMTS). Pour mémoire, les ophtalmologistes libéraux reçoivent 26,5 millions de patients par an. L’extrapolation France entière conduit à estimer le nombre de patients gérés par les médecins généralistes au minimum à 3,3 millions chaque année.
Parmi les patients consultant en urgence, 85 % sont des adultes de moins de 70 ans, tandis que 5 % sont des enfants. Selon la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES) [7], 28 % des patients consultant un médecin généraliste ont plus de 70 ans. Il semble en revanche que les patients plus âgés sollicitent moins les médecins généralistes pour leurs problèmes oculaires (fig. 2-4-8). Il est possible qu’en avançant en âge, il est plus fréquent d'avoir un ophtalmologiste attitré auquel on fait appel en cas de DSNPO.
Le patient a parfois vu un autre professionnel de santé avant de voir le médecin généraliste. Le recueil de données dont nous disposons montre que les patients consultant un généraliste pour un problème oculaire n’ont vu aucun médecin auparavant (naïfs) dans 80 % des cas. Ils pouvaient cependant s’automédiquer ou s’être administré le traitement conseillé et dispensé par le pharmacien. Le corps infirmier a parfois conseillé la consultation. Une seule fois, ce fut l’opticien (fig. 2-4-9).
Dans les données dont nous disposons dans l’étude d'Angers, le début des troubles a été renseigné pour 257 fiches parmi 587 (43,27 %). Ils dataient généralement de moins de 2 jours et dans plus de 70 % des cas de moins de 6 jours (fig. 2-4-10).
Dans l’enquête angevine, les médecins généralistes traitaient 36 % d'affections générales aiguës dans leur activité. Ils en adressaient directement environ 5 %. En revanche, selon nos enquêtes, pour ce qui concerne la sphère oculaire, ils en adressaient 12 à 50 %. Ils adressent donc plus volontiers les urgences ophtalmologiques.
Pourtant, la prise en charge du problème oculaire par le généraliste est globalement fréquente. Il prend en charge 50 à 88 % des patients qui s’adressent à lui. Trois quarts de ces cas étaient pris en charge sans arrière-pensée dans l’enquête d'Angers. Il jugeait initialement utile/nécessaire de revoir le patient ou de l’adresser dans un quart des cas, si le traitement s’avérait inefficace. Lorsqu’il adressait, c’était à un confrère ophtalmologiste dans trois quarts des cas et en SU pour les autres cas. Le choix d'adresser à un ophtalmologiste ou en SU dépend probablement du contexte local et du réseau individuel constitué par le médecin généraliste.
Bien qu’ils prennent en charge un grand nombre des DSNP à caractère ophtalmologique, environ deux tiers des médecins généralistes évaluent leurs connaissances en ophtalmologie comme insuffisantes sur ce sujet. Moins de 5 % estiment que leurs connaissances en la matière soient satisfaisantes [5] pour assurer pleinement leur rôle dans ce domaine.
Le rôle du médecin généraliste à son cabinet médical est de comprendre la plainte symptomatique du patient afin de prendre en charge ou d’orienter au plus vite. Si la demande de soin est ressentie comme urgente par le patient, la réalité de l’urgence peut être différente [8]. Le médecin généraliste a donc un rôle de triage médical mais aussi de médiateur. Le médecin généraliste,par ses compétences, va devoir rassurer le patient lorsque cela est possible, en même temps que d’organiser ses soins.
Le médecin généraliste soulage la douleur en première ligne. Au cabinet, il doit pouvoir et savoir réaliser un examen clinique ophtalmologique de base. Il doit savoir reconnaître les vraies urgences ophtalmologiques. Ainsi, il accélère la prise en charge spécialisée. Pour ce faire, il doit avoir dans son équipement et sa trousse d'urgence le matériel minimal nécessaire :
- –
à la réalisation d'un examen ophtalmologique basique ;
- –
pour initier, éventuellement, un traitement s’il le juge utile (tableau 2.4.1).
Tableau 2.4.1Matériel et connaissances indispensables au médecin généraliste pour faire face à l'urgence ophtalmologique en première ligne.Pour examiner et prendre en charge une urgence oculaire, l'omnipraticien doit: Avoir I Savoir I De la fluorescéine et des anesthésiques locaux Retourner une paupière Une lampe, voire une loupe éclairante et un ophtalmoscope Réaliser un toucher orbitaire bidigital Des éponges montées Examiner les pupilles, le réflexe photomoteur Des aiguilles stériles Ôter un corps étranger superficiel Des rondelles oculaires Ne pas extraire un corps étranger profond Du sérum physiologique Rincer une surface oculaire Un collyre antibiotique ou pommade Évaluer un champ visuel au doigt Une pommade cicatrisante/lubrifiante (vitamine A) Évaluer le circuit d'orientation spécialisé le cas échéant Une pince à épiler précise Épiler un cil trichiasique
Comme pour la médecine générale, l’offre de soins est variable suivant les départements et les délais de prise en charge peuvent être longs. Ainsi, pour un médecin généraliste, il peut être compliqué d'orienter un patient vers une prise en charge ophtalmologique spécialisée. En amont de l’urgence, le médecin généraliste doit prévoir de se référer à plusieurs ophtalmologistes avec lesquels un contact téléphonique sera privilégié, pour obtenir un avis ou une consultation en urgence en cas de nécessité. En collaboration avec un ophtalmologiste du secteur et la maison pluriprofessionnelle de santé locale éventuelle, il est possible d'établir à l’avance des protocoles d'orientation des urgences ophtalmologiques, comme il est d'usage d'assurer en concertation pluriprofessionnelle le dépistage de la vision chez l’enfant ou le contrôle des patients diabétiques. Par ailleurs, la communication entre l’ophtalmologiste et le généraliste contribue à prévenir certaines consultations d'urgence, comme celles liées aux effets indésirables survenant à l’instauration de collyre comme les collyres antiglaucomateux (voir plus loin). Dans l’enquête en Haute-Garonne [5], 80 % des médecins généralistes avaient un ophtalmologiste correspondant, et un sur dix avait même instauré une feuille de consultation dédiée à l’ophtalmologie.
Nous avons constaté dans les deux études mentionnées ci-dessus, essentiellement trois motifs de consultation : l’œil rouge, les pathologies de la paupière et la sensation de corps étrangers, souvent assimilée à une douleur. La survenue d'une altération visuelle représentait 5 % des demandes urgences à motif ophtalmologique, contre 40 % d'yeux rouges et 10 % d'yeux douloureux. La proportion de rougeurs et de douleurs oculaires rapportées aux médecins généralistes semble approximativement identique à celle traitée par les pharmaciens (fig. 2-4-11).
En revanche, les médecins généralistes reçoivent légèrement plus de patients rapportant des altérations visuelles. Lorsqu’elles existent, ils envoient plus facilement à l’ophtalmologiste. Dans l’étude d'Angers, ils prenaient tout de même en charge une majorité de ces patients (fig. 2-4-12).
Parmi les consultations urgentes ophtalmologiques d'un omnipraticien, le corps étranger oculaire (pénétrant ou non pénétrant) représentait tout de même 10 % des motifs (étude Haute-Garonne). Ces données rejoignent celles d'autres études, sans être totalement superposables en raison des disparités territoriales [9].
Lors de la prise en charge d'un soin oculaire, le médecin généraliste utilise ou prescrit parfois des collyres. Contrairement au pharmacien, il emploie une majorité d'antibiotiques et des collyres contenant un corticoïde une fois sur cinq (fig. 2-4-13).
Un autre motif rare de consultation d'urgence auprès du médecin généraliste est l’urgence générale liée à l’ophtalmologie. En effet, l’omnipraticien peut être amené à prendre en charge en urgence une pathologie générale liée à un problème ophtalmologique. L’exemple type est la crise d'asthme ou la décompensation respiratoire d'une bronchopneumopathie chronique obstructive (BPCO) à la suite d'une prescription ophtalmologique de bêta-bloquant. Certains traitements ophtalmologiques, comme les antifongiques, ont des conséquences sur l’équilibre d'un traitement décoagulant coumadinique, à risque de syndrome hémorragique. L’association de tétracyclines avec un dérivé de la vitamine A (traitement de l’acné) peut générer une hypertension intracrânienne. Ces exemples ne sont bien sûr pas exhaustifs. Le médecin généraliste s’assure donc des interactions qu’il peut y avoir entre les médicaments ophtalmologiques et les pathologies générales ainsi qu’entre les traitements généraux et une atteinte ophtalmologique.
Au total, les deux études mettent donc en évidence le rôle de première ligne majeur que jouent le pharmacien et le médecin généraliste pour filtrer les consultations d'ophtalmologie. En pratique, ces deux professionnels traitent plus qu’ils n’adressent, ce qui est méconnu. Le nombre de patients traités pour des symptômes oculaires d'urgence est in fine considérable. Il est évident que les spécialistes ophtalmologistes ne pourraient pas les accueillir tous en première ligne.
-
L’omnipraticien reçoit un faible pourcentage de patients avec plainte d'urgence oculaire (1,23 % à 3 %).
-
Il est sollicité par des patients jeunes pour les motifs oculaires.
-
Il fait face à un panel de situations ophtalmologiques très variées.
-
Il gère la majorité des patients avec une plainte oculaire.
-
Il absorbe annuellement environ 3,3 millions de DSNPO.
-
Il anticipe ces demandes grâce à un matériel d'examen et un arsenal thérapeutique de première ligne adaptés.
-
Il organise en amont le recours d'urgence avec ses ophtalmologistes et SU référents.
Les services d’urgence ont été restructurés par les décrets du 22 mai 2006. Préalablement appelés UPATOU, ils s’appellent désormais « services d’urgence ». Au nombre de 655, ils assurent la prise en charge 24 heures/24 et 7 jours/7 des soins urgents et des soins non programmés. Ils sont majoritairement hospitaliers (77 %) [3]. En 2015, il en existait 132 (1/5) qui appartenaient à des établissements privés à but lucratif. Leur ouverture est dépendante du schéma régional d’organisation des soins (SROS) et donc des Agences régionales de santé (ARS).
Comme le souligne le rapport de J.-Y. Graal, en 2015, sur la territorialisation des activités d'urgence [10], « dans une grande agglomération, la problématique n’est pas tant la ressource médicale ou de soins, que l’efficience de son organisation et sa lisibilité ». Il ajoute : « En revanche, en zone rurale, il s’agit d'optimiser une ressource moins disponible en médecins qualifiés pour répondre à la DSNP. » Il indique enfin que « pour améliorer la filière de prise en charge des patients au sein des territoires, il convient de permettre aux patients ne relevant pas de l’urgence vraie de trouver une réponse extra-hospitalière adaptée à leur situation. Il a d'ailleurs été démontré que ces patients recourent aux urgences hospitalières faute d'autres accès aux soins, du moins connus et accessibles par eux ». Les patients imaginent que le secteur libéral ne fonctionne qu’en horaires de bureau et que la permanence des soins (PDS) n’existe pas en secteur libéral [8].
Il faut reconnaître que la disponibilité de l’offre libérale ophtalmologique diminue, surtout dans les petites et moyennes villes. Il devient dès lors difficile de gérer les DSNP en amont de la SU. Il est naturellement plus facile de s’appuyer sur elle en positionnant les ophtalmologistes disponibles en recours. D’après la DREES, 2,5 millions de patients se sont tournés vers le service d'urgence du privé lucratif en 2014 [3].
Dans l’exemple du département de la Sarthe, il existe deux SU, une hospitalière et une privée. Pendant l’année 2015, il y a eu 32 463 passages dans la structure privée, dont 3,13 % concernaient l’ophtalmologie. Ce pourcentage a été confirmé au premier semestre 2016 avec 17 812 passages dont 3,10 % de causes ophtalmologiques. On arrive donc à un flux annuel d'environ 1 000 patients. Cela correspond au travail d'un ophtalmologiste à temps plein pendant 7 ou 8 semaines. Une autre manière d'appréhender ce flux est de considérer que cela représente 3 patients par jour, ce qui apparaît alors gérable.
Au niveau national, on pourrait extrapoler que les 132 SU privées à but lucratif voient 78 000 problèmes ophtalmologiques car elles gèrent 2 520 000 passages par an. Il faut ajouter à cela les DSNPO parmi le million de passages pris en charge des 39 établissements privés non lucratifs en 2014. Ainsi, un total d'environ 110 000 patients avec problèmes oculaires semble être pris en charge chaque année dans les « structures d'urgence » des établissements privés.
L’organisation des urgences sur un territoire renvoie à la notion de « permanence des soins » (PDS). Les dispositions de l’article 49 de la loi n° 2009-584 du 21 juillet 2009, dite loi « hôpital, patients, santé et territoire » (HPST ; article L. 6314-1 et suivants du Code de la santé publique), et du décret du 28 juillet 2010 stipulent que la PDS est « une mission de service public à laquelle participent les médecins libéraux et les médecins des centres de santé, en collaboration avec les établissements de santé ».
La loi précise que les médecins ainsi que les associations de PDS élaborent dans chaque territoire le tableau des gardes nominatif mis en œuvre pour une durée minimale de 3 mois après que le conseil départemental de l’Ordre des médecins a vérifié que les intéressés sont en situation régulière d'exercice et, le cas échéant, constaté l’absence ou l’insuffisance des médecins volontaires. Ensuite, le conseil départemental de l’Ordre des médecins transmet ces éléments à la Direction générale des agences régionales de santé (DGARS), au préfet de département, aux services d'aide médicale urgente, aux médecins et associations, et aux caisses d'assurance maladie. En cas de carence sur le tableau, le directeur général de l’ARS, après un processus de consultation notamment de l’Ordre des médecins et de l’Union régionale des professionnels de santé (URPS), communique au préfet de département les informations pour qu’il procède aux réquisitions nécessaires.
Le rôle de l’ARS est de vérifier que la PDS est bien effective.D’après le conseil national de l’Ordre des médecins, la PDS se caracté- rise par « un dispositif permettant de garantir l’accès de la population à un médecin, pour des soins non programmés, lorsque les cabinets médicaux sont fermés la nuit, les week-ends et les jours fériés ».Ainsi, la France est divisée en 1 707 territoires de PDS gérés par les 100 conseils départementaux de l’Ordre des médecins.Cette organisation est axée sur la médecine générale de premier recours, mais elle a vocation à s’étendre à la médecine spécialisée.
Une enquête, réalisée pour cet ouvrage en septembre 2016 depuis la liste de diffusion des ophtalmologistes francophones (ListeOFF), a permis de recueillir des informations sur l’organisation territoriale de gestion des urgences dans le monde libéral. Elle a suscité 109 réponses couvrant 94 départements. D’après cette étude, 98 % des répondants reçoivent les urgences au fil de l’eau lors de leur présence au cabinet (fig. 2-4-14). Cet échantillon n’est pas représentatif de la population générale ophtalmologique puisqu’un cabinet sur cinq n’accepte aucun nouveau patient (voir plus loin), même pour une DSNP (demande urgente). En revanche, presque un département sur quatre s’est doté d'une organisation libérale structurée 24 heures/24 et 7 jours/7. Certaines organisations sont soutenues par le conseil national de l’Ordre des médecins et d'autres s’organisent en dehors de tout circuit officiel.
a. Répartition nyctémérale de la prise en charge (PEC). b. Consultation additionnelle de PEC.
L’astreinte en soutien d'une SU est aussi très répandue. Dans certains territoires, plusieurs ophtalmologistes organisent une astreinte informelle pour leurs correspondants et leur clinique. Parfois les astreintes ne sont assurées que par les ophtalmologistes chirurgicaux. Enfin, une règle tacite organise que les confrères soient exclus des listes d'astreinte à partir de 60 ans.
Dans de nombreux territoires, l’hôpital assure la PDS le soir, la nuit et le week-end. Certains territoires ont organisé une astreinte alternée entre l’hôpital et la ville, mais les ophtalmologistes hospitaliers sont de toute façon d'astreinte pour leur établissement.
Enfin, hormis la facturation de l’acte, il n’est pas prévu de rémunération spécifique pour la PDS, qui est pourtant une mission de service public obligatoire. À noter que 98 % des répondants déclarent recevoir les urgences au fil de l’eau pendant leurs heures de consultations, sans être intégrés à une organisation territoriale structurée. Une enquête multicentrique descriptive réalisée dans le Grand Ouest français recensait 5,7 % de DSNPO au sein des consultations libérales ophtalmologiques, dont 8,9 % de syndromes douloureux, 8,1 % de larmoiements et 7,3 % de prurits [11].
Au total, il existe de multiples formes d'organisation de la PDS sur le territoire. Il en découle une absence de lisibilité et une certaine difficulté d'information pour la population. La PDS est désormais sous la tutelle de l’ARS, à qui il revient de l’organiser.
L’urgence médico-chirurgicale est un sujet de choix pour une analyse des pratiques, car tout le monde comprend que ce domaine vise la perfection en matière d'accès aux soins. Dans l’intérêt des patients, dans l’intérêt de l’organisation des soins, il est crucial de connaître et d'analyser les fonctionnements non conformes (sousoptimaux) des prises en charge. Le Syndicat national des ophtalmologistes français (SNOF), avec l’appui d'un laboratoire pharmaceutique, a conduit des enquêtes d'évaluation de la réponse des secrétariats des cabinets d'ophtalmologie aux situations de DSNP depuis 2011. Quatre scénarios de DSNP à des degrés d'urgence divers ont été élaborés, ainsi qu’un scénario témoin qui correspondait à une demande de rendez-vous normal programmée sans urgence (fig. 2-4-15). Le périmètre de l’étude a progressivement évolué. Initialement réalisée auprès de 40 cabinets libéraux en décembre 2011, elle a été reconduite en décembre 2012 auprès de 120 centres (dont 20 % hôpitaux), puis en 2013 auprès de 140 centres (dont 12 % hôpitaux), puis en 2015 et 2016 auprès de 100 centres (dont 25 % d'hôpitaux). Une segmentation plus fine a été utilisée en 2015 et 2016 pour isoler les réponses des centres qui prenaient en charge le traitement de la dégénérescence maculaire liée à l’âge (DMLA). Les cabinets ont été choisis au hasard et équilibrant leur distribution selon les régions, avec 20 % des appels en région parisienne. Des quotas fixaient que la moitié des appels se fasse lors des pics d'appels et l’autre moitié hors des pics d'appels. Le descriptif des scénarios est dans la figure 2-4-15 . Le recul de cette étude a permis d'analyser l’évolution des comportements des secrétariats.
Il y a quelques années le sujet de l’accueil des urgences ne se posait pas en raison de la facilité avec laquelle les patients obtenaient un rendez-vous. Même avec un secrétariat inefficace, le patient urgent arrivait à voir le médecin dans des délais convenables. Aujourd'hui, obtenir un simple rendez-vous, pour un patient inconnu de la structure ophtalmologique, est devenu très difficile. La situation s’est beaucoup dégradée entre 2011 et 2016 témoignant de la tension qui existe sur l’offre de soins (fig. 2-4-16).
En 2011, 100 % des appels obtenaient un rendez-vous.
Le premier scénario a pour but de simuler une DMLA sur un premier d'œil chez un patient inconnu de la structure.
Dans le premier scénario, l’introduction du patient « mystère » se faisait par cette phrase : « Je suis inquiet depuis quelques jours je vois moins bien. » Aux questions éventuelles des secrétaires, il était prévu d’apporter les précisions suivantes : j’ai 60 ans, je suis gêné de loin et de près, mes troubles ont commencé il y a 2 ou 3 semaines et ils surviennent pour la première fois. Si l’assistante demandait de cacher un oeil, alors le patient apportait les précisions suivantes : « C’est seulement de l’oeil droit. Je vois une tache grise au milieu de mon champ de vision droit et les lignes se déforment. » Dans le cas où l’assistante ne posait pas de questions, l’enquêteur précisait alors ces symptômes dans le but de voir si cette information provoquait un raccourcissement du délai. Ce scénario a été perçu par les secrétaires plus comme un trouble brutal de la vision générique qu’une DMLA débutante.
Il met en évidence une difficulté à obtenir un rendez-vous. En 2011, 17 % des patients avaient été renvoyés. Ce taux a augmenté au fil des années pour atteindre 38 % en 2015 puis 58 % en 2016 (fig. 2-4-17).
Les rendez-vous, même pour une urgence, sont de plus en plus difficiles à obtenir pour les nouveaux patients. En revanche, le délai médian de prise en charge, à condition d’obtenir un rendezvous, est satisfaisant, si on soustrait l’année 2013 (fig. 2-4-18). Le pourcentage de rendez-vous donnés au-delà de 15 jours a baissé de façon importante montrant l’amélioration de la prise en charge. Les délais moyens se sont améliorés de façon significative.
De nombreux patients qui sollicitent un rendez-vous en urgence ne l’obtiennent pas. Tout ce passe comme si l’interlocuteur donnait le bon rendez-vous au patient ou, ne pouvant le faire, renvoyait le patient. Quand l’organisation de l’offre de soins d’urgence renvoie la moitié des demandes de rendez-vous en urgence, l’accompagne-ment du refus de rendez-vous devient un enjeu de santé publique. La loi impose à la structure qui ne peut pas donner le rendez-vous d’indiquer au patient un point de chute pertinent, c’est-à-dire un renvoi avec coordonnées précises (article 47 du Code de déontologie et article R. 4127‑47 du Code de la santé publique). À noter qu’environ 20 % des structures libérales testées refusent tout nouveau patient quel que soit le motif de la demande.
Paradoxalement, il est plus facile d'obtenir un rendez-vous simple, seulement 20 % de refus, qu’un rendez-vous non programmé (58 % de refus en 2016) (fig. 2-4-19).
Le deuxième scénario met en scène le cas d'un patient ayant déjà eu un œil traité pour une DMLA exsudative, qui appelle une structure ophtalmologique car il est inquiet des signes apparaissant sur l’œil adelphe. Le patient est inconnu de la structure. Pour un patient inconnu de la structure, présentant une DMLA du second œil, il est de plus en plus difficile d'être pris en charge en urgence (fig. 2-4-20). Au total, la situation s’améliore peu à peu mais pour la DMLA du second œil de larges progrès restent à faire.
Ce troisième scénario concerne un enfant de 3 ans qui louche depuis quelques jours. Il s’agit d'une urgence relative. On s’attend à avoir un rendez-vous en quelques jours. Le suivi sur plusieurs années montre clairement une évolution négative de la prise en charge des enfants. Celle-ci se dégrade nettement : en 2016, 61 % des enfants qui présentaient un strabisme depuis quelques jours ont été renvoyés (fig. 2-4-21). En revanche, ceux qui obtiennent un rendez-vous, l’obtiennent de plus en plus rapidement. L’hôpital a autant de difficultés que le libéral à faire face à la demande (fig. 2-4-22).
Les études du SNOF montrent qu’il existe depuis 2011 une grande difficulté pour les nouveaux patients à obtenir un rendez-vous d'ophtalmologie, même en cas d'urgence dans le cadre d'une DSNP.
La tendance sur plusieurs années montre une amélioration des délais pour les personnes acceptées mais objective un plus grand nombre de patients refusés. Le cas des enfants est particulier en ce sens que, par définition, ils appartiennent au groupe des « nouveaux patients ». Leur situation se dégrade constamment depuis le début de l’étude. Enfin, en 2016, on a constaté que 20 % des cabinets refusaient tous les nouveaux patients sans distinction.
Il y a environ 3 millions de déménagements par an. Si on considère que les familles comportent en moyenne 3 personnes, on peut estimer alors que 9 millions de personnes changent d’habitation chaque année. Toutes ces personnes se trouvent en position d’être « nouveaux patients » ce qui, on le voit, est un statut très pénalisant pour l’accès aux soins, surtout dans un contexte d’urgence. L’amélioration constante de la qualité des soins d’urgence s’accompagne, au-delà du délai, d’une dégradation de l’accès à ces soins, dans un contexte d’effondrement de la démographie libérale.
Ces études révèlent toute l’importance de l’analyse de ce qu’il se passe sur le terrain, en vie réelle. Elles montrent aussi la nécessité d’avoir des secrétaires bien formées car leur rôle s’est modifié. Il a évolué de la prise simple de rendez-vous jusqu’à la régulation des flux de patients. Cette nouvelle fonction a des implications médicales et médico-légales, car ce rôle reste supervisé par le médecin. Des formations voient le jour en ce sens.
La qualité d’un service ou d’une prestation n’existe pas dans l’absolu, mais elle existe selon un point de vue. La qualité des soins d’urgence ophtalmologique peut être perçue et attendue par le patient différemment de celle voulue par le médecin. En cas d’urgence ressentie, le patient souhaite pouvoir avoir accès à un (son) ophtalmologiste, et être pris en charge rapidement. L’offre de soins n’est pas toujours adaptée au flux de ce type de demande.
L’ophtalmologiste, comme tout médecin, a l’obligation d'un exercice de qualité sans faille (article R. 4127-33 du Code de la santé publique et article 33 du Code de déontologie). Cela peut se traduire par des consignes données à son secrétariat pour accepter le nombre d'urgences (DSNP) qu’il peut gérer déontologiquement. Le collaborateur médical qui régule le flux des patients fait face à deux injonctions contradictoires : recevoir les DSNP sans méconnaître un vrai item d'urgence et permettre au médecin de travailler convenablement. Le médecin ne peut matériellement pas être informé de toutes les réponses qui sont faites par son secrétariat au cours d'une journée et donner des consignes individuelles. Les audits trouvent ici leur intérêt.
La prestation médicale d’urgence ne se réduit pas à la compétence médicale du médecin. Elle englobe aussi l’organisation du flux des demandes urgentes d’avis ophtalmologique faite au médecin ou à ses collaborateurs.
Une enquête personnelle a colligé de manière exhaustive tous les dossiers des patients reçus en consultation non programmée pendant 18 mois, de mars 2015 à septembre 2016. Le but était d'analyser le volume et la diversité des motifs de DSNPO d'un ophtalmologiste généraliste médical sans sur-spécialité. Elle a permis de collecter 311 fiches d'observation sur 10 465 consultations programmées, soit 3 % des patients reçus. La faiblesse de ce chiffre est à mettre en regard avec le ressenti du médecin qui a le sentiment d'être souvent sollicité pour des DSNP. Parmi ces 311 patients, plus des quatre cinquièmes étaient naïfs (n = 261), 15 avaient reçu un traitement de la part du pharmacien, 3 avaient vu leur médecin généraliste et 3 étaient passés par le service d'urgence hospitalier. Un seul était passé par le service d'urgence de la clinique, et un seul avait vu un confrère ophtalmologiste. En somme, il ne s’agissait généralement pas de patients déjà pris en charge par ailleurs. Il s’agissait principalement d'altérations visuelles ou de sensation de corps étranger (fig. 2-4-23). Seulement 37 % des patients consultaient avec des signes fonctionnels de moins de 72 heures. À l’issue de la consultation, 301 urgences ont pu être gérées complètement, 5 ont été adressées à un confrère pour les examens complémentaires, 3 ont été adressées à l’hôpital, 4 avaient un examen normal sans suites. Le motif le plus fréquent de consultation en urgence était les myodésopsies, généralement qualifiées de baisse d'acuité visuelle en rapport avec un décollement postérieur du vitré (tableau 2.4.2). Signalons que pour seulement 6 patients, le diagnostic n’a pas pu être posé le jour de la consultation. L’étude a posteriori de ces 6 dossiers montre une évolution spontanément favorable de 3 baisses d'acuité visuelle, ainsi que la disparition des douleurs et de la sensation de corps étranger sous traitement probabiliste. Pour un patient sur cinq, le(s) symptôme(s) correspondai(en)t à un item représentant moins de 1 % des urgences.
BAV : baisse d'acuité visuelle.
| Diagnostic proposé | Proportion |
|---|---|
| Décollement postérieur du vitré | 15 % |
| Chalazion | 9 % |
| Syndrome sec | 8 % |
| Conjonctivite | 7 % |
| Hémorragie sous-conjonctivale | 7 % |
| Diagnostic non fait en urgence | 7 % |
| Traumatisme cornéoconjonctival | 5 % |
| Corps étranger cornéen | 4 % |
| Kératite | 4 % |
| Allergie | 3 % |
| Réfraction urgente | 3 % |
| Neuro-ophtalmologie | 3 % |
| Cils et pathologie associée | 3 % |
| Macula | 3 % |
| Examen normal | 3 % |
| Dysfonction meibomienne | 2 % |
| Cataracte | 2 % |
| Postopératoire | 2 % |
| Corps étranger sous-palpébral | 2 % |
| Uvéite antérieure aiguë | 2 % |
| Strabisme, phories | ≤ 1 % |
| Tumeur bénigne évolutive | ≤ 1 % |
| Épisclérite | ≤ 1 % |
| Exploration demandée | ≤ 1 % |
| Douleurs orbitaires projetées | ≤ 1 % |
| Ptérygion inflammatoire | ≤ 1 % |
| Zona ophtalmique | ≤ 1 % |
| Hypertonie | ≤ 1 % |
| Hémorragie intravitréenne | ≤ 1 % |
| Décollement de rétine | ≤ 1 % |
| Kératoconjonctivite | ≤ 1 % |
| Piqûre insecte | ≤ 1 % |
| Crise aiguë de fermeture de l'angle (CAFA) | ≤ 1 % |
| Érosion épithéliale récidivante | ≤ 1 % |
La demande de consultation en urgence est quasiment toujours justifiée. Bien que donnant l’impression de constituer un flux important de patients, elle est finalement modeste.
Contrairement au généraliste pour qui les conjonctivites catarrhales sont la première cause de consultation, elles ne sont qu’en quatrième position en ophtalmologie libérale. Le signe fonctionnel qui prédomine est l’altération visuelle. Un très large éventail de pathologies forme 1 % ou moins des pathologies reçues en urgence en ophtalmologie libérale. En effet, les groupes de pathologies figurant au tableau 2.4.2 correspondent à de multiples entités ophtalmologiques différentes, à prise en charge spécifique. Cela interdit d'éventuelles délégations de tâche dans ce domaine.
Les enquêtes sur la réponse des secrétariats aux situations d'urgence présentées précédemment montrent que des facteurs inattendus influent le délai de rendez-vous.
L’analyse nous montre que les délais sont raccourcis de façon significative lorsque le patient apporte des informations complémentaires.
Les scénarios prévoyaient qu’après avoir obtenu le rendez-vous, l’enquêteur essayait d’obtenir un délai de rendez-vous plus court en fournissant des explications complémentaires. On voit sur la figure 2-4-24 qu’il y a un grand intérêt à négocier en apportant de nouveaux éléments à la demande de rendez-vous. L’impact sur les secrétariats est moins évident en secteur hospitalier peut-être à cause de l’existence d’unité d’urgence. L’amplitude de l’amélioration des délais varie aussi en fonction des pathologies présentées. (fig. 2-4-24.)
La reformulation et l’apport de détails auprès de la personne qui fixe le délai de rendez-vous influent sur cette dernière. On pourrait de fait s’interroger sur l’impact de la barrière linguistique.
L’influence de l’heure d'appel a été étudiée en 2011 en différenciant les demandes lors du pic d'appels et les demandes hors du pic d'appels. Les demandes de rendez-vous obtenues hors pic d'appels sont plus efficaces : le délai est plus court. On constate cependant que l’urgence reste relative puisque le délai moyen est de 40 jours si l’appel survient pendant un pic et de 21 jours si l’appel est en dehors de ce pic. Il est donc bénéfique de choisir son créneau horaire pour demander un rendez-vous d'urgence ophtalmologique.
L’influence de l’inscription du cabinet à la démarche qualité par une association d'ophtalmologistes impliquée dans une démarche qualité, la Nouvelles Organisations de soins en ophtalmologie (NOSO), a été étudiée en 2013. Il existait une différence dans la prise en charge en fusionnant le premier et le deuxième scénarios (trouble brutal de la vue et DMLA du second œil). Un quart des secrétariats participant à une démarche qualité donnait un rendez-vous aux DSNP dans les 2 jours, contre 16 % pour les autres scénarios. En revanche, il n’a pas été trouvé de différence entre les centres concernant l’accueil des enfants. Enfin, les secrétariats participant à une démarche qualité posaient au moins une question plus fréquemment que les autres. L’implication des cabinets libéraux dans une démarche qualité influe positivement sur le délai de prise en charge des urgences ophtalmologiques.
Il semble exister de fortes variations inter-régionales (fig. 2-4-25). En Île-de-France, les rendez-vous d'urgence sont les plus faciles à obtenir, sans pour autant répondre totalement à la demande.
IDF : Île-de-France.
Les données analysables suggèrent l’existence de facteurs surprenants qui influencent le choix des collaborateurs médicaux dans l’attribution du rendez-vous d'urgence ophtalmol ogique.
-
98 % des ophtalmologistes libéraux disent recevoir les urgences au fil de l’eau.
-
Un département sur quatre s’est doté d'une organisation libérale structurée 24 heures/24, 7 jours/7.
-
L’astreinte en soutien d'une structure d'urgence est aussi très répandue.
-
Les consultations non programmées correspondent à 3 % des patients reçus.
-
Il y a une réelle difficulté pour les nouveaux patients à obtenir un rendez-vous, même en cas d'urgence.
-
L’obligation d'un exercice de qualité sans faille (article R. 4127-33 du Code de la santé publique et article 33 du Code de déontologie) signifie accepter le nombre de patients déontologiquement gérables.
-
Les motifs fréquents de consultation sont les myodésopsies (qualifiées de baisse d'acuité visuelle) ou la sensation de corps étranger, et couvrent également un très large éventail d'items d'urgence.
-
La demande de consultation en urgence est généralement justifiée.
L’analyse du parcours de soins des urgences ophtalmologiques en secteur libéral met en évidence six portes d'accès au soin : automédication, pharmacien, médecin généraliste, structure d'urgence, ophtalmologiste et urgences ophtalmologiques hospitalières. Il existe un flux considérable de patients traités en amont de l’ophtalmologiste. Le système de soins français autorise le patient à s’adresser indifféremment et librement à n’importe quel niveau. Un patient présentant une altération visuelle ressentie comme urgente peut initier sa prise en charge de l’offre de soins de la moins spécialisée à la plus experte. L’offre de soins optimale suppose que si le problème persiste, le patient doit être référé à un niveau supérieur d'expertise pour l’urgence qui le concerne plutôt que vers un niveau moins expert.
[1] Rault JF, Le Breton-Lerouvillois G, Bouet P. Atlas de la démographie médicaleen France, situation au 1er janvier 2016. Conseil national de l’Ordre des médecins. En ligne : https://www.conseil-national.medecin.fr/sites/default/files/atlas_de_la_demographie_medicale_ 2016.pdf
[2] Bour T. Les besoins en ophtalmologistes d’ici 2030. Académie française d’ophtalmologie ; mars 2011. En ligne : http://www.ophtalmo.net/SNOF/temp/Rapport_Snof_2011_ Final.pdf
[3] DREES. La médecine d’urgence. Les établissements de santé. Édition 2016. En ligne : http://drees.solidarites-sante.gouv.fr/IMG/pdf/fiche29‑2.pdf
[4] Delolme MP, Law-Ki A, Belon JP, et al. Place du pharmacien de ville dans la prise en charge des patients en ophtalmologie. Journal Français d’Ophtalmologie 2011 ; 34 : 168‑74.
[5] Courrière V. Urgences ophtalmologiques en médecine générale, élaboration d’un CDROM interactif 2008.
[6] Michel P. Urgences de nuit du médecin généraliste. Reanimation Urgences 1997 ; 6 : 79‑84.
[7] Labarthe G. Les consultations et visites des médecins généralistes : un essai de typologie. Études et Résultats DREES 2004, no 315.
[8] Gentile S, Amadei E, Bouvenot J, et al. Attitudes et comportement des usagers face à une urgence réelle ou ressentie. Santé publique 2004 ; 16 : 63‑74.
[9] Minozzo L. Le médecin généraliste face à l’urgence ophtalmologique, enquête auprès de 109 médecins de Midi-Pyrénées : guide pratique à l’usage du médecin généraliste [thèse d’exercice]. Université de Midi-Pyrénées ; 2006.
[10] Grall JY. Rapport sur la territorialisation des activités d’urgences. Juillet 2015. En ligne : http://drees.solidarites-sante.gouv.fr/IMG/pdf/fiche29‑2.pdf
[11] Santiago P, Becquet F, Zanlonghi X, Bosc J. Eds. Étude qualitative et quantitative de la consultation ophtalmologique en France : enquête multicentrique descriptive. 123e Congrès de la Société française d’ophtalmologie ; 2017 ; Paris.
Urgences ophtalmologiques en établissement public
J.-L. BOURGES, F. BEHAR-COHEN, A. PISON
J.-L. BOURGES
-
Les établissements de soins observent une croissance constante de la fréquentation en structure d'urgence ophtalmologique (SUO).
-
Ils sont géographiquement organisés en réseau sous la forme de groupements hospitaliers de territoire.
-
Ils ont accueilli environ 400 000 patients ayant une demande de soins non programmés d'ophtalmologie (DSNPO) en 2016 via les structures d'urgence (SU) des centres hospitaliers universitaires (CHU).
-
Ils accueillent les patients ayant une DSNPO par l’intermédiaire de SU générales ou directement en SUO.
-
Le nombre de leur DSNPO semble équilibré entre chaque jour de la semaine, avec un pic d'augmentation quotidien en fin de matinée. Il existe néanmoins des variations imprévisibles d'affluence de patients ayant une DSNPO.
-
Ils offrent la possibilité d'une prise en charge globale s’ils sont plurispécialitaires, ce qui est souvent utile voire, dans certains cas, totalement indispensable.
Les structures du service public français qui accueillent les urgences ophtalmologiques s’intègrent plus globalement dans l’organisation sanitaire française. Cette dernière s’appuie sur des hôpitaux universitaires, des hôpitaux généraux, des hôpitaux militaires et sur la participation au service public des établissements de santé privés (PSPES). Il existe désormais, sous l’impulsion du législateur, des axes de coopération entre les établissements appelés groupement hospitalier de territoire (GHT). Ils ont vocation à organiser une prise en charge collaborative du flux des patients, complémentaire et permanente entre établissements (fig. 2-5-1 ). Ainsi, un petit établissement ne disposant pas de permanence ophtalmologique oriente conventionnellement ses DSNPO en horaires de garde vers un autre établissement qui en dispose. Ce dernier adresse les items d'urgence ophtalmologique nécessitant un plateau technique élaboré vers un troisième établissement qui dispose d'une SUO. Dans les projets médicaux partagés des GHT, l’organisation des urgences représente le deuxième pôle d'intérêt
1. Source : DOMU/ARS 2017.
après la chirurgie. La permanence des soins (PDS) et les soins critiques bénéficient au premier chef de ce mode d'organisation.Sur un territoire donné, plusieurs établissements de santé publics ou privés coexistent : centre hospitalier universitaire (CHU), centre hospitalier général (CH), établissement hospitalier spécialisé (H), établissement sanitaire participant à la permanence des soins (PDSES). Ils se trouvent à des distances variables les uns des autres et doivent parfois tenir compte des contraintes géographiques de leur territoire. Ils déterminent ensemble un GHT autour de projets médicaux partagés (PMP). Un PMP peut être l’organisation et la prise en charge des demandes de soins non programmés d'ophtalmologie. Selon sa compétence et son équipement, un établissement peut prendre en charge en première ligne ou adresser ces demandes d'ophtalmologie dans le cadre d'un schéma territorial de priorité. Un établissement – ici, le CHU – est le référent de recours ultime.
Les établissements hospitaliers qui accueillent les DSNPO sont en principe dotés de SU générales ou parfois de SU dédiées à l’ophtalmologie. Nous avons mené une enquête en 2017 auprès des services ophtalmologiques de tous les CHU et hôpitaux militaires de France (métropoles et départements et régions d'outre-mer [DROM] ; voir chapitre 2.2 ). L’intégralité des CHU a répondu via leurs chefs de service d'ophtalmologie. Nous avons pu identifier au moins 22 structures dédiées à l’accueil des urgences ophtalmologiques, labellisées ou non SU, réparties sur le territoire français. Parmi ces structures, 14 sont dotées d'un médecin ophtalmologiste de garde. Si tous les CHU n’ont pas une SU dédiée exclusivement à l’ophtalmologie, tous ont organisé de manière formalisée un accueil des urgences ophtalmologiques dans leur service d'ophtalmologie. Parmi les CHU, 19 ont déclaré accueillir les urgences ophtalmologiques via les urgences générales en horaires de garde. En règle, ces CHU se sont dotés d'une astreinte ophtalmologique.
Il existe une tendance croissante et constante de la demande de soins non programmés (DSNP) auprès des établissements publics de santé en France [1]. Cette tendance se confirme en ophtalmologie [2]. La demande de soins d'urgence en ophtalmologie représente 3,4 % des demandes totales de soins d'urgence en établissement de santé [3]. Elle se répartit pour les trois quarts pendant les heures ouvrables et pour un quart lors des heures de permanence de soins [4]. Expliquer cela par la raréfaction de l’offre de soins ophtalmologiques en France ne serait pas suffisant. Cette tendance n’est pas spécifique à la France. Elle est internationale [5–7]. Le vieillissement démographique, l’évolution de l’ophtalmologie vers l’ultraspécialisation et la haute technologie sont d'autres paramètres qui contribuent à privilégier les soins d'urgence centralisés au détriment de ceux de proximité [6]. Par ailleurs, le recours aux SU institutionnelles pour des soins ophtalmologiques considérés comme non urgents augmente dans les catégories de population généralement à faible revenu, dont les jeunes et les minorités ethniques [3].
En plus d'être un recours, les SUO sont des supports d'expertise auprès des professionnels de santé médicaux et paramédicaux. Elles sont sollicitées en routine par des moyens de communication distants : un ophtalmologiste contacte son confrère urgentiste pour organiser la stratégie de prise en charge d'un item d'urgence oculaire, un patient appelle pour un avis en rapport avec son œil, etc. Elles pratiquent donc des actes médicaux de télémédecine en permanence. En effet, un acte médical est défini par « tout acte dont la réalisation par des moyens verbaux, écrits, physiques ou instrumentaux est effectuée par un membre d'une profession médicale dans le cadre de son exercice et les limites de sa compétence » d'après la Commission de terminologie et de néologie pour le domaine de la santé (séance du 14 juin 2001, encadré 2-5-1 ). Ces actes sont donc soumis aux mêmes règles déontologiques et médico-légales que tout acte médical. Deux points sensibles liés à l’acte télémédical d'urgence doivent inciter à la vigilance des médecins sollicités : le secret professionnel (confidentialité des données, sécurité des échanges) et la traçabilité des actes et soins dans le dossier médical. Il faut savoir que le médecin qui émet un avis distant (télé-expertise) doit s’entourer de tous les éléments suffisants pour cela, sous peine d'engager sa responsabilité. De même, lorsqu’un médecin est demandeur d'un avis auprès d'une SUO, il peut engager sa responsabilité quant au choix et à la qualité des informations transmises à son confrère. Une fois l’avis expert rendu, il demeure responsable de l’exploitation de cet avis, et donc de ses décisions médicales. Enfin, il existe une recommandation de bonne pratique clinique concernant les actes de régulation télédistants (typiquement pour le centre 15), mais qui s’applique aussi à l’ophtalmologie [8].
Encadré 2-5-1
La télémédecine, selon l’agence régionale de santé, « met en rapport entre eux, par la voie des nouvelles technologies, soit le patient et un ou plusieurs professionnels de santé, soit plusieurs professionnels de santé » (www.ars.sante.fr/latelemedecine). Elle est aussi définie dans l’article L. 6316-1 (loi no 2009-879 du 21 juillet 2009) du Code de la santé publique qui précise que « la définition des actes de télémédecine ainsi que leurs conditions de mise en oeuvre et de prise en charge financière sont fixées par décret, en tenant compte des déficiences de l’offre de soins dues à l’insularité et l’enclavement géographique ». Son déploiement est un des dix engagements du Pacte territoire santé (article 78). Le décret no 2010-1229 du 19 octobre 2010 autorise cinq actes : la téléconsultation, la télé-expertise, la télésurveillance, la télé-assistance et la régulation médicale. Si l’ophtalmologie d’urgence se prête encore mal à la téléconsultation et la télésurveillance, en revanche la télé-expertise, la téléassistance et la régulation médicale sont possibles en urgence ophtalmologique.
Les patients consultent plus volontiers d'eux-mêmes en SU d'établissement de soins pour une DSNPO. Selon les régions géographiques, le taux des patients auto-adressés en SU pour une DSNPO varie entre 18 et 85 % [9–12]. En Europe et aux États-Unis, cette proportion avoisine les 50 %%. Les horaires ouvrés, c’est-à-dire hors PDS, ne sont pas identiques dans tous les établissements de soins. Ils pourraient être définis allant de 8 heures à 20 heures par analogie avec ceux inscrits dans la loi « hôpital, patients, santé et territoire »» (HPST) pour le secteur libéral. En fait, on observe plus volontiers des horaires de PDSES allant de 18 heures à 8 heures.
En continuité de soins hors PDSES, l’accueil des DSNP est effectué par le service d'ophtalmologie. Il s’organise pour cela avec sa logistique propre et individuellement. Il intègre les DSNP dans son organisation, selon son modèle de soins courants ( same day care ). Certains services d'ophtalmologie ont développé des compétences surspécialitaires particulières. Généralement, ceux-ci offrent en plus un accueil spécifiquement adapté à l’urgence de leur domaine de compétence (neuro-ophtalmologie, pédiatrie, chirurgie de cornée, chirurgie de rétine, dégénérescence maculaire liée à l’âge [DMLA], etc.).
En horaire de PDS, l’accueil ophtalmologique d'urgence s’effectue majoritairement dans la SU générale de l’établissement, avec un médecin urgentiste de garde en première ligne et un ophtalmologiste d'astreinte en recours (fig. 2-5-2 ). La compétence ophtalmologique d'un médecin urgentiste est décrite dans le référentiel de la Société francophone de médecine d'urgence (SFMU) [13]. Il doit connaître les étiologies et la prévalence des items nécessitant une prise en charge en urgence pour une douleur oculaire et en fonction de l’âge. Il doit être capable :
- –
de procéder à l’ablation d'un corps étranger non enclavé de l’œil et de ses annexes ;
- –
devant une douleur oculaire, d'évaluer la nécessité d'un recours urgent à un avis ophtalmologique ;
- –
devant une douleur oculaire, de reconnaître, prendre en charge et orienter les pathologies suivantes : conjonctivite, kératite, orgelet, chalazion, blocage pupillaire, corps étranger ;
- –
en fonction des étiologies évoquées, de mettre en œuvre les différentes stratégies diagnostiques et thérapeutiques recommandées pour une douleur oculaire.
PDS : permanence des soins ; SU : structure d'urgence.
Ces demandes sont orientées vers la SU d'ophtalmologie pour les quelques établissements qui en disposent. Il peut s’agir d'établissements exclusivement dédiés à l’ophtalmologie. Là, un(e) infirmier(ière) accueille les patients. Il(elle) procède à une première anamnèse puis un triage des demandes de soins et oriente les patients vers l’ophtalmologiste de permanence. Ils sont ensuite dirigés vers un ophtalmologiste surspécialitaire au besoin. Il existe une formation infirmière dédiée à l’accueil et l’orientation, avec le grade d'infirmier(ière) organisateur(trice) de l’accueil (IOA) [14]. Elle est générale et n’existe pas (encore) pour l’ophtalmologie en France, comme c’est le cas dans quelques grands instituts ophtalmologiques universitaires internationaux.
Il existe probablement autant de circuits de prise en charge que d'établissements. On peut cependant schématiser deux types prédominant d'accueil des urgences dans les établissements de soins : l’accueil général suivi d'un triage éventuel vers la spécialité ophtalmologique ou l’accueil direct en environnement ophtalmologique (fig. 2-5-2 ). Dans les établissements de soins, les DSNPO convergent vers ces deux types d'accueil. La première option est la plus répandue sur le territoire français comme à l’étranger. Elle offre l’avantage d'épargner la ressource ophtalmologiste, rare, et de mutualiser les ressources. Les médecins urgentistes gèrent correctement les items d'urgence ophtalmologique simples et stéréotypés [15]. Leur engagement permet de désengorger l’accès aux ophtalmologistes pour des items simples et peu sévères [16]. L’accueil en SU d'ophtalmologie permet en revanche un accès plus rapide et mieux adapté aux soins ophtalmologiques plus complexes ou plus sévères. Leur spécificité est souvent mal appréhendée par les soignants non spécialisés [17]. Elle offre en outre un accès unique au plateau technique d'ophtalmologie hautement spécifique. Pour un établissement, entretenir une SU d'ophtalmologie nécessite un bassin de population et une offre de soins ophtalmologiques suffisants. Bien sûr, l’item d'urgence ophtalmologique peut être associé à un item d'urgence locorégionale ou générale. La possibilité de prendre en charge un patient dans tous les aspects de ses soins d'urgence est généralement le privilège des établissements de soins hospitaliers publics ou privés labellisés pour la permanence des soins des établissements de santé (PDSES). Ils proposent une offre de soins ouverte sur un large éventail de spécialités, qui collaborent entre elles le cas échéant.
D’un point de vue individuel, le parcours de soins du patient qui s’adresse à un établissement de soins pour une DSNPO comprend cinq étapes : l’acheminement, l’accueil, le triage, la prise en charge de l’item d'urgence et l’aval d'urgence (fig. 2-5-3 ). Les grandes étapes du parcours individuel d'une demande de soins d'urgence dans un établissement de santé répondent généralement à un schéma commun, adapté par chaque établissement à son offre de soins, à l’offre de soins territoriale et à son bassin de population.
À partir d'un schéma de base, chaque établissement adapte son offre à l’offre de soins territoriale et à son bassin de population. Chaque étape mobilise la catégorie de personnel de santé adaptée. SMUR : service mobile d'urgence et de réanimation ; SU : structure d'urgence.
Il n’existe pas aujourd'hui de consensus officiel ni de directive opposable sur l’équipement minimal à usage ophtalmologique dont devrait disposer une SU qui accueille des DSNPO. Il n’existe pas non plus de protocole universel pour l’accueil et l’orientation des patients. En revanche, les SU sont pourvues de protocoles (voir plus loin). Ils indiquent la conduite à tenir face à une DSNPO : le plus simple indique seulement le numéro du recours médical d'ophtalmologie ; le plus élaboré indique à l’omnipraticien son champ de prise en charge et celui du recours au spécialiste.
Par définition, la SU générale est équipée pour prendre en charge les items d'urgence non ophtalmologique, en particulier les urgences vitales. Si elle est dotée d'un espace spécifique à l’ophtalmologie, la SFMU écrit dans ses recommandations qu’« une salle spécialement conçue pour les examens ophtalmologiques et ORL est parfois souhaitable. Elle contient l’équipement de ces spécialités. Elle est située au mieux à la périphérie, entre secteur ambulatoire et secteur couché. Elle doit pouvoir être utilisée comme salle d'examen standard » [18]. Pour accueillir les DSNPO, elle doit disposer d'un minimum de matériel spécifique. Dans un modèle de SU générale accueillant les items ophtalmologiques en première ligne, des auteurs observaient une disponibilité de 100 % de la fluorescéine, de 90 % de l’anesthésiant topique et de 59 % des lancettes/pointes mousses pour le retrait des corps étrangers superficiels oculaires [19]. Toute urgence générale devrait raisonnablement disposer d'un ophtalmoscope avec lumière bleue. Son usage polyvalent et son faible coût justifient cela amplement (réflexes pupillaires, examen des papilles optiques, observation des zones prenant la fluorescéine ou d'un signe de Seidel, conversion possible en otoscope, etc.). Au mieux, il est envisageable d'installer une lampe à fente en « poste avancé » pour l’ophtalmologiste de recours. Il peut ainsi réaliser un examen de première ligne discriminant, et limiter l’accès au service d'ophtalmologie parfois distant ou plus difficile d'accès en horaires de PDS. Sans être exhaustif, on peut ainsi proposer une liste pratique de matériel utile à la prise en charge des patients consultants pour un motif ophtalmologique hors structure d'ophtalmologie (voir tableau 2-4-1 ).
À la différence d'un SU générale, une SUO n’a pas vocation à prendre en charge des urgences vitales. Elle doit cependant être conçue et équipée pour pouvoir faire face aux premiers soins dans cette éventualité (classification infirmière des malades aux urgences de niveau 1 ou CIMU-1).
De ce point de vue, sa conception reprend certaines recommandations de la SFMU (encadré 2-5-2 ). Elle doit disposer au minimum d'un défibrillateur cardiaque semi-automatique (DSA), d'un chariot d'urgence (composition consensuelle : voir annexe 2-5-1 ) [20] et d'un accès aux fluides médicaux (oxygène, air comprimé, vide). Bien évidemment, elle dispose d'un poste d'examen ophtalmologique permettant au minimum l’évaluation de l’acuité visuelle, la réalisation d'une biomicroscopie et la mesure du tonus oculaire. Elle dispose d'un poste de soins permettant la réalisation de gestes oculaires (prélèvements diagnostiques, rinçage oculaire, instillations, sondage lacrymal, pansement) mais aussi généraux (hémostase, décubitus à plat urgent pour massage cardiaque, décubitus déclive, mesure et monitorage des constantes générales, perfusion et prélèvements sanguins, administrations thérapeutiques et injections).
Encadré 2-5-2
La SUO est dotée des caractéristiques suivantes :
-
elle est fléchée, visible et accessible de la porte principale de l’hôpital par un circuit dédié ;
-
son entrée est distincte ;
-
elle est située sur un même niveau et de plain-pied ;
-
les locaux sont exclusivement destinés à l’urgence
-
elle n’est traversée par aucun flux étranger à son activité ;
-
les circulations des patients et des accompagnants ne traversent pas les zones de soins ;
-
elle est sectorisée en zones fonctionnelles : zone d'accueil, zone de soins, zone technique, zone de service, unité de surveillance de courte durée ;
-
l’accès à la zone de soins est réservé aux personnes autorisées ;
-
elle permet une surveillance efficace des patients en même temps que la protection (visuelle, acoustique) de leur intimité et de la confidentialité ;
-
elle est implantée à proximité du bloc opératoire accueillant les items chirurgicaux d'ophtalmologie ;
-
le stockage principal est situé en périphérie de la SUO et évite la pénétration des livreurs ;
-
le matériel est disponible dans des chariots de soins équipés ;
-
elle possède le matériel du lavage et de la désinfection des mains ;
-
les matériaux sont adaptés à un usage intensif et un trafic élevé.
Cette structure nécessite l’accessibilité permanente à un plateau technique général adapté à l’ophtalmologie. L’ophtalmologie d'urgence utilise de manière routinière l’imagerie radiologique conventionnelle craniofaciale, la tomodensitométrie (TDM), l’imagerie par résonance magnétique (IRM) et l’angio-IRM, les explorations de laboratoires en biologie (bactériologie, virologie, parasitologie), la biochimie, l’hématologie et la toxicologie. De même, le lien avec la pharmacie centrale hospitalière est privilégié (collyres renforcés, médicaments de spécialité).
Annexe 2-5-1
Selon les directives de conférence de consensus, la dotation minimale uniforme d’un chariot d’urgence est la suivante [20] :
À titre d’exemple, la composition et l’organisation des chariots d’urgence des hôpitaux universitaires Paris Centre (HUPC) est la suivante :
-
défibrillateur semi-automatique (DSA), si possible débrayable en mode manuel ;
-
bouteille d’oxygène à manodétendeur intégré, vérifiée et prête à l’emploi ;
-
médicaments : adrénaline, dérivés nitrés (injectable et spray), atropine, lidocaïne, amiodarone, furosémide, soluté glucosé à 30 %, benzodiazépine injectable, β-2-adrénergiques (spray et solution pour aérosol), solutés de perfusion conditionnés en poche souple (NaCl à 0,9 %, colloïdes de synthèse) ;
-
matériel de ventilation : canules de Guedel no 2 et 3, masques faciaux no 3 à 6, ballon autoremplisseur à valve unidirectionnelle et filtre antibactérien, masques pour aérosol, sondes à oxygène, tuyaux de connexion, masques à haute concentration ;
-
matériel pour accès veineux et injections : seringues de 5 et 10 mL, jeu d’aiguilles, cathéters courts 14-16-18-20-22 G, perfuseurs avec robinets à 3 voies, compresses stériles, solution antiseptique, garrot, champs adhésifs transparents, adhésif de fixation, gants non stériles, container à aiguilles, lunettes de protection, solution hydro-alcoolique ;
-
matériel d’aspiration : système d’aspiration vérifié et prêt à l’emploi, sondes d’aspiration trachéo-bronchiques, sondes pour aspiration gastrique, seringue de Guyon (50 mL à embout conique), sac à urine non stérile, raccords biconiques ;
-
plan dur pour massage cardiaque.
Le volume des DSNPO prises en charge par les établissements de santé français est exposé dans le chapitre 2.2 . Nous avons recensé environ 400 000 passages motivés par des DSNPO dans les SU des 32 CHU de métropole et des DROM (fig. 2-5-4 ). Si on élargit ces données à tous les établissements de soins français, on considère qu’ils ont pris en charge plus de 700 000 DSNPO en 2016. On observe que ce volume augmente chaque année.
CHG : centre hospitalier général ; HC Lyon : hospices civils de Lyon.
La prise en charge des items d'urgence ophtalmologique est de nature très variable selon les SU et les années. Globalement, il semble quand même qu’environ 60 % des urgences hospitalisées soient de nature médicale et 40 % de nature chirurgicale. Les types d'items d'urgence ophtalmologique sont détaillés dans le chapitre 2.3 . Aucune donnée fiable ne permet de comparer à ce jour la nature des items pris en charge selon le type d'établissements. Il apparaît cependant que l’orientation surspécialitaire d'un établissement influe sur la nature de son recrutement d'urgence, comme l’illustre le travail que nous avons conduit en 2016 auprès de trois SUO parisiennes (recueil de données homogènes sur les passages aux urgences de l’hôpital Cochin, de la fondation ophtalmologique
Adolphe de Rothschild et de l’hôpital des Quinze-Vingts sur une période de 15 jours consécutifs) et que nous détaillons ci-dessous.
Pour les trois SUO parisiennes, le temps d'attente médian pour l’accès à un soignant qui évalue la demande de soins était de 3 minutes (moyenne = 13 minutes). Le temps d'attente médian entre la première évaluation et l’examen médical était de 1 heure 21 (moyenne = 1 heure 43). À titre de comparaison, ces temps médians étaient pour les passages en SU générale respectivement de 5 minutes et 30 minutes [21]. Ils sont proportionnellement plus courts pour les patients qui seront hospitalisés. Lorsqu’il existe plusieurs SU capables de prendre en charge l’ophtalmologie d'urgence sur un même territoire, comme dans Paris intramuros, on observe une homogénéisation des temps d'attente. Le flux de patients a tendance à se répartir spontanément entre les SU, sans que les déterminants de ce phénomène ne soient encore clairement connus (seuil de temps d'attente, information aux patients, réseaux sociaux, etc.).
En reprenant le profil des patients consécutifs qui se sont présentés au SUO de l’Assistance publique-Hôpitaux de Paris (AP-HP) de janvier à juin 2017 (n = 12798), nous n’avons pas relevé de jour significativement plus ou moins chargé qu’un autre (fig. 2-5-5 ). Le dimanche est le jour le moins chargé, avec un rattrapage le lundi, jour le plus chargé. Les horaires d'affluence sont représentés sur la figure 2-5-5 . Il existe un pic d'affluence quotidien en fin de matinée. Comme pour les prévisions météorologiques, il existe des modèles de prévision des pics d'affluence en SU générale [22]. Ils semblent assez efficaces. Ils montrent jusqu’à 95 % de robustesse à prédire des pics épidémiques. Ils n’ont pas (encore) été adaptés à l’ophtalmologie.
On observe la sinusoïdale d'affluence en fonction des heures de présentation des patients chaque jour de la semaine dans la structure d'urgence ophtalmologique de l’AP-HP. a, b. Répartitions hebdomadaires (a) et horaires (b) pour chaque jour de la semaine observées sur 6 mois consécutif (janvier à juin 2017). c. Répartition des passages et des admissions sur 12 mois consécutifs (mai 2016 à juin 2017).
La disponibilité des soignants et des ressources de la SU au sein de l’établissement doit être dimensionnée pour pouvoir absorber les pics de la courbe sinusoïde d'affluence quotidienne (fig. 2-5-5 ), mais aussi hebdomadaire et annuelle.
L’aval des SUO est détaillé plus loin. Il s’agit des options possibles de continuité de soins offertes à l’ophtalmologiste qui a pris en charge une DSNPO. En établissement de soins, ces options s’articulent autour de l’hospitalisation conventionnelle, l’hospitalisation ambulatoire, la consultation post-urgence rapide en ophtalmologie, la consultation ophtalmologique dans les délais, une consultation chez un médecin non-ophtalmologiste (omnipraticien, traitant, autre spécialiste) ou simplement une absence d'aval s’il n’est pas utile.
Entre 2 et 4 % des personnes reçues en urgence sont hospitalisées (fig. 2-5-5 ), pour les deux tiers en hospitalisation traditionnelle. Les séjours d'hospitalisation en provenance des urgences ophtalmologiques AP-HP représentaient environ 10 % des séjours globaux du service entre 2014 et 2016. La durée moyenne de ces séjours était de 3 ± 0,3 jours. Les urgences hospitalisées étaient principalement des urgences rétiniennes chirurgicales, des infections aiguës et des plaies du globe ocu-laire
2. Source : programme de médicalisation des systèmes d'information (PMSI) 2017, urgences ophtalmologiques AP-HP.
. Le nombre de séjours pour les établissements de santé et leur durée moyenne pour chaque code diagnostique de la classification commune des actes médicaux (CCAM ; exemple pour les urgences : décollement de rétine, ablation de corps étranger oculaire, suture de plaie de cornée, etc.) sont disponibles par année sur le site de l’Agence technique de l’information sur l’hospitalisation (ATIH) à l’adresse suivante : http://www.scansante.fr .
Les SU générales et ophtalmologiques des établissements de santé tendent de plus en plus à favoriser les pratiques consensuelles et l’homogénéité des prises en charge. Pour cela, elles peuvent utiliser trois moyens principaux : la seniorisation des professionnels d'urgence, la délégation de tâches et la protocolisation des pratiques professionnelles.
Au niveau des SUO, cela se traduit par la formation spécifique médicale et paramédicale à l’urgence en ophtalmologie. La collaboration traditionnelle avec les infirmiers(ères) s’étoffe de celle avec les orthoptistes, qui sont autorisés à initier l’examen ophtalmologique dans leur domaine de compétence encadré par le décret de compétence de leur profession, ou en délégation de tâches protocolisée sous responsabilité médicale (encadré 2-5-3 ). En pratique dans le contexte d'urgence, ils sont amenés à évaluer la fonction visuelle, le tonus oculaire ou effectuer des actes d'imagerie oculaire de première ligne. Enfin, les procédures et protocoles sont abordés plus loin.
Encadré 2-5-3
Mise en place par la loi no 2009-879 HPST du 21 juillet 2009 dans son article 51, la démarche de coopération entre professionnels de santé prévoit que soit organisé un transfert de tâches et de compétences au travers de protocoles pluriprofessionnels. Le protocole doit être jugé conforme par la Haute autorité de santé (HAS) et validé par l’Agence régionale de santé (ARS) concernée pour s’appliquer sur un territoire voire être ensuite généralisé sur le territoire français. Concernant l’orthoptie, la délégation de tâches ophtalmologiques est encadrée par le décret no 2016-1670 du 5 décembre 2016 relatif à la définition des actes d’orthoptie et aux modalités d’exercice de la profession d’orthoptiste. Dans le cadre d’urgence, le champ de compétences de l’orthoptiste est utile. Il peut exercer en application d’un protocole organisationnel préalablement établi, daté et signé par un ou plusieurs médecins ophtalmologistes exerçant au sein d’un établissement de santé. L’orthoptiste est habilité à réaliser un interrogatoire et à recueillir les informations concernant le patient et son entourage dans le respect du secret professionnel. Il peut effectuer des actes d’exploration en utilisant éventuellement des appareils destinés à traiter les anomalies de la fonction visuelle. L’orthoptiste peut préparer l’examen médical du médecin ophtalmologiste. Il est habilité à déterminer l’acuité visuelle et la réfraction, avec ou sans dilatation – les médicaments nécessaires à la réalisation étant prescrits par le médecin –, à procéder à l’irrigation de l’oeil et instillation de collyres ou à recueillir des sécrétions lacrymales.
Renforcer la compétence des acteurs de l’urgence en ophtalmologie est aussi une mission des structures d'urgence hospitalières ou des établissements de santé (voir chapitre 3.3 ). Ils dispensent une formation initiale en élaborant des procédures et des protocoles de soins, en s’accordant sur des référentiels. La présence d'étudiants en médecine et d'internes de spécialité en SU et leur participation à la PDS contribuent à cette formation. Ils dispensent aussi une formation continue spécifique dans ce domaine au travers de diplômes universitaires, d'enseignements post-universitaires destinés à la spécialité ou à d'autres praticiens (omnipraticiens notamment). Les publications scientifiques qui émanent majoritairement de ces établissements contribuent à la formation médicale continue sur l’urgence en ophtalmologie.
Les établissements de santé évaluent l’activité de soins non programmés par le volume des soins ophtalmologiques d'urgence et leur valorisation. Les indicateurs principaux sont le nombre de passages inscrit dans la SU, le nombre de majoration accueil et traitement des urgences (ATU), la valorisation de l’activité par le forfait annuel urgences (FAU ; voir chapitre 3.2 ) et des travaux universitaires (par les missions d'intérêt général ou MIG et par le score du système d'interrogation, de gestion et d'analyse des publications scientifiques (SIGAPS) des unités de soins).
Les indicateurs médicaux courants de qualité des soins non programmés sont le nombre et la liste des refus de prise en charge, le nombre de signalements de fonctionnements non conformes, des retours après plus de 24 heures, des aller-retour pendant la nuit profonde, le délai entre l’heure d'arrivée dans l’établissement d'origine et l’heure d'admission dans l’établissement missionné PDSES (voir chapitre 2.1 ), le nombre de dossiers de contentieux, le temps de réponse aux appels distants et le délai d'attente accueil/soin médical.
On observe une croissance constante de la fréquentation du SUO des établissements de soins. Les secours adressent de manière privilégiée les items d'urgence oculaire vers les établissements de santé et leurs structures d'urgence. Ils accueillent approximativement autant de DSNPO que l’ophtalmologie de cabinet. Les DSNPO des patients sont gérées par l’intermédiaire de SU générales ou directement en SUO. Tous n’ont pas un médecin ophtalmologiste de garde, mais tous ont organisé l’accès à un ophtalmologiste en cas de nécessité (garde ou astreinte). Parmi les DSNPO reçues en établissement public, entre 2 et 4 % sont hospitalisés, en majorité pour motif médical (60 %%).
[2] Rigal‑Sastourné JC. Rapport d’expertise PSDES nuit profonde en ophtalmologie. 2012. En ligne : http://www.sante‑iledefrance.fr/PDSES/RAPPORT_OPHTALMO_PDSES.pdf
[3] Stagg BC, Shah MM, Talwar N, et al. Factors affecting visits to the emergency department for urgent and nonurgent ocular conditions. Ophthalmology 2017 ; 124 : 720‑9.
[4] Vartsakis G, Fahy G. The profi le of patients attending a triaged eye emergency service. Irish Journal of Medical Science 2014 ; 183 : 625‑8.
[5] MacEwen C, Buchan J. The way forward : options to help meet demand for the current and future care of patients with eye disease. En ligne : https://www.rcophth.ac.uk/ wp‑content/uploads/2015/10/RCOphth‑The‑Way‑Forward‑Glaucoma‑300117.pdf
[6] Siempis T. Urgent eye care in the uk increased demand and challenges for the future. Med Hypothesis Discov Innov Ophthalmol 2014 ; 3 : 103‑10.
[7] Smith HB, Daniel CS, Verma S. Eye casualty services in London. Eye 2013 ; 27 : 320‑8.
[8] HAS. Modalités de prise en charge d’un appel de demande de soins non programmés dans le cadre de la régulation médicale. 2011.
[9] Kadyan A, Sandramouli S, Caruana P. Reorganisation of the ophthalmic casualty in a district teaching hospital. J ESONT 2007 ; 1 : 9‑15.
[10] Perumal D, Niederer R, Raynel S, McGhee CN. Patterns of ophthalmic referral and emergency presentations to an acute tertiary eye service in New Zealand. The New Zealand Medical Journal 2011 ; 124 : 35‑47.
[11] Fenton S, Jackson E, Fenton M. An audit of the ophthalmic division of the accident and emergency department of the Royal Victoria Eye and Ear Hospital, Dublin. Irish Medical Journal 2001 ; 94 : 265‑6.
[12] Bhopal R, Parkin D, Gillie R, Han K. Pattern of ophthalmological accidents and emergencies presenting to hospitals. Journal of Epidemiology & Community Health 1993 ; 47 : 382‑7.
[13] Prével M, Andronikof M, Coudert B, et al. Référentiel de compétences d’un médecin d’urgence. SFMU ; juin 2004. En ligne : http://www.sfmu.org/upload/referentielsSFMU/ competences_medecins_urgences.pdf
[14] Fehre A, Chauvin A, Durand‑Stocco C, et al. Évaluation de l’application d’un triage par la classifi cation infi rmière des malades aux urgences par des infi rmiers organisateurs de l’accueil en comparaison avec un triage realise par un medecm. Annales Françaises de Médecine d’Urgence 2015 ; 5 : 150‑8.
[15] Jeannin A, Mouriaux F, Mortemousque B. Prise en charge des urgences ophtalmologiques en structure des urgences : étude multicentrique rétrospective. J Fr Ophtalmol 2016 ; 39 : 589‑95.
[16] Banerjee S, Beatty S, Tyagi A, Kirkby GR. The role of ophthalmic triage and the nurse practitioner in an eye‑dedicated casualty department. Eye 1998 ; 12 : 880‑2.
[17] Nari J, Allen LH, Bursztyn LLCD. Accuracy of referral diagnosis to an emergency eye clinic. Canadian Journal of Ophthalmology 2017 ; 52 : 283‑6.
[18] Bleichner G, Braun F, Burnouf JM, et al. Architecture des services d’urgence : Recommandations de la Société francophone de médecine d’urgence. Journal Européen des Urgences 2005 ; 18 : 102‑26.
[19] Jeannin A, Mouriaux F, Mortemousque B. Prise en charge des urgences ophtalmologiques en structure des urgences : étude multicentrique rétrospective. Journal Français d’Ophtalmologie 2016 ; 39 : 589‑95.
[20] Gueugniaud P, Ammirati C, Baqué S, et al. Recommandations pour l’organisation de la prise en charge des urgences vitales intrahospitalières. Réanimation 2005 ; 14 : 671‑9.
[21] Ricroch L, Vuagnat A. Temps, parcours et délais aux urgences : résultats de l’enquête nationale. Revue d’Épidémiologie et de Santé Publique 2015 ; 63 : S18‑S9.
[22] Afi lal M, Yalaoui F, Dugardin F, et al. Modèles de prévision robuste de l’affl ux des patients des urgences. Revue d’Épidémiologie et de Santé Publique 2017 ; 65, suppl. 1 : S9‑S10.
F. BEHAR-COHEN
-
Le temps d'attente est un critère majeur de qualité en SU.
-
L’attente en SU a des conséquences pour les patients (santé, souffrance, insatisfaction) et pour le personnel soignant (motivation, fatigue, stress).
-
L’attente est moins bien perçue aux âges extrêmes de la vie, en cas de défaut d'information, d'une grande promiscuité et de l’existence d'une barrière linguistique.
-
Le temps d'attente peut être optimisé par le triage, la spécialisation du personnel paramédical, l’accès privilégié au spécialiste, l’accès permanent et dédié au bloc, l’organisation de l’aval, l’analyse des données d'accueil et de fonctionnement.
-
La seniorisation des urgences ophtalmologiques participe à réduire le temps d'attente.
-
L’objectif d'attente maximal est fixé à 4 heures dans le système de santé britannique.
Le temps d'attente dans les services d'urgence constitue l’un des critères d'évaluation de la qualité des systèmes de santé dans la plupart des pays industrialisés et l’un des critères comparatifs objectifs entre les différents systèmes [1, 2]. Le temps étant une variable quantitative facilement mesurable et accessible et l’attente un objet constant d'insatisfaction de la part des patients, le temps d'attente constitue un critère en apparence objectif pour les patients et les parties prenantes (payeurs, gestionnaires des systèmes de santé, assurances, etc.). Le temps d'attente est par ailleurs souvent assimilé à l’inefficacité du système de santé, soumettant les individus à des souffrances prolongées et à l’insatisfaction [3, 4]. Les méthodes utilisées pour évaluer ce temps d'accès aux soins, qu’il s’agisse de soins urgents ou électifs, ne sont à ce jour pas uniformisées dans les différents pays rendant ce paramètre finalement peu fiable pour répondre à un objectif comparatif [5]. Il est actuellement essentiellement utilisé pour évaluer l’accès à des procédures chirurgicales électives, permettant d'apprécier dans quelle mesure une équité peut être assurée entre les citoyens dans différents systèmes de santé. En revanche, le temps d'attente aux urgences est un paramètre fiable dans un système donné pour suivre l’évolution et l’amélioration de l’organisation des services d'urgences.
Le temps d'attente dans les unités d'urgence résulte de la gestion d'amont de l’ensemble des unités de soins, non seulement en termes de ressources humaines et techniques mais également en termes d'organisation des soins, de circuits des patients et de régulation des flux. Il résulte aussi, in fine, de la politique de santé et de soins à laquelle les systèmes de santé sont soumis.
Nous rappelons ici les mesures d'amont qui contribuent à réguler et réduire le temps d'attente et de passage aux urgences (fig. 2-5-6 ) :
- –
un système de triage efficace assurant une discrimination sensible et spécifique des cas en fonction de leur gravité et assignant des objectifs de délai de prise en charge. Un système efficient de surveillance de ces délais assorti d'une boucle d'amélioration est un garant du système ;
- –
un personnel spécifiquement affecté et formé aux urgences ophtalmologiques, en particulier la présence de médecins seniors et formé aux urgences ;
- –
un mélange de compétences ( skill mix ) signifiant une répartition des tâches et des délégations de compétences contrôlées à tous les échelons de la prise en charge ;
- –
la mise en place de consultations « post-urgence » sur rendez-vous évitant d'encombrer les urgences avec des suivis et contrôles qui s’accumulent jour après jour ;
- –
une orientation rapide vers des spécialistes, ce qui signifie que les autres départements doivent également prévoir des plages de rendez-vous dans des délais compatibles avec la gravité du cas mais aussi avec la demande des patients ;
- –
un accès au bloc opératoire permanent avec des plages spécifiquement réservées pour les urgences et une équipe dédiée à la chirurgie d'urgence, indépendante des chirurgies programmées. Leur nombre doit être en permanence ajusté en fonction du nombre de cas chirurgicaux urgents ;
- –
une analyse rétrospective du nombre d'urgence sur plusieurs années tenant compte des fluctuations horaires, mensuelles, périodes de vacances, variations climatiques, etc. Cette analyse permet ensuite d'ajuster au mieux les ressources nécessaires. Ces variations sont extrêmement dépendantes de conditions locales et environnementales et le degré de granularité de leur analyse permet d'améliorer la qualité des prévisions. Par exemple, dans certaines régions, tous les ophtalmologistes du secteur privé s’absentent à certaines dates pour participer à une conférence nationale, ce qui génère un afflux accru de patients vers le seul service d'urgence ophtalmologique de la région à cette période. Les pics d'affluence varient en fonction des mois, des jours de la semaine et des heures de la journée, de façon plus ou moins homogène selon les modes de vie et les rythmes scolaires, de travail mais aussi en fonction d'événements locaux (match de football ou de base-ball, par exemple). Mais on observe une certaine rythmicité qui permet d'ajuster les effectifs en fonction des besoins (fig. 2-5-6 et 2-5-7 ) ;
Fig. 2-5-7 Variation sinusoïdale du volume de passages en structure d'urgence d'ophtalmologie, constatée sur 4 semaines à l’hôpital ophtalmique Jules-Gonin (Lausanne, Suisse).
Elle aide à ajuster les effectifs en fonction de l’affluence prévisible. - –
un système de gestion informatique des patients qui alerte quand un nombre critique est atteint. Ce nombre représente le nombre de patients en salle d'attente que les ressources présentes ne peuvent pas gérer dans des délais compatibles avec les objectifs fixés. Cette alerte doit déclencher la mise à disposition d'équipes soignantes supplémentaires. Cela signifie que l’hôpital ou la clinique doivent être en mesure d'embaucher un personnel qui peut être mobilisé aux urgences en cas de besoin. Ce personnel médical et/ou paramédical peut être mobilisé facilement s’il est spécifiquement affecté à des tâches académiques ou d'organisation et reste disponible en cas d'affluence. Cela implique que plusieurs équipes d'urgence de jour puissent effectuer des roulements et n’est envisageable que dans les services à grande affluence ;
- –
fixer la réduction du temps d'attente comme un objectif prioritaire et motiver, encadrer les équipes pour les aider à atteindre cet objectif.
Si certaines de ces mesures peuvent facilement être mises en œuvre, d'autres requièrent des moyens dépendant des politiques de santé des différents États. Les moyens (humains, organisationnels, techniques, gestion, etc.) et les volumes de patients (expérience des personnels, rentabilité) requis pour parvenir à des services d'urgence ophtalmologique performants et efficients conduisent à concentrer les urgences sur un petit nombre de centres. Nous aborderons plus loin les réflexions et développements de la télémédecine pouvant répondre à des besoins d'expertise dans des régions éloignées des centres d'urgence.
Plusieurs pays publient les résultats des temps d'attente aux urgences générales comme un indicateur de la qualité de leur système de soins. Par exemple, l’Australie a publié les résultats d'une enquête visant à évaluer si les objectifs fixés par la politique de santé ont été respectés. Les patients issus du triage sont séparés en deux groupes, ceux qui nécessitent une réanimation et pour lesquels le soin doit être immédiat et ceux présentant un cas moins urgent qui doivent selon leurs standards être pris en charge dans les deux heures. Les données étaient accessibles pour 6,5 millions d'urgences dans la plupart des hôpitaux publics d'Australie, ce qui représente 83 % des urgences vues dans les hôpitaux publics entre 2011 et 2012. Le temps recommandé de prise en charge, noté dans les dossiers des patients, était conforme aux recommandations dans 72 % des cas, mais dans 100 % des cas de réanimation et 66 % des cas moins urgents, 50 % des patients ont été pris en charge en moins de 21 minutes et 90 % en moins de 108 minutes. Une réduction significative des temps d'attente était notée entre 2007-2008 et 2011-2012, malgré l’augmentation du nombre d'urgences [6].
L’attente aux urgences est due à une inadéquation entre la demande de soins et les ressources requises pour répondre à cette demande [7]. Un nombre accru de patients et/ou l’accroissement de cas complexes mais des ressources humaines constantes conduisent inévitablement à l’accroissement du temps d'attente, les personnels de santé atteignant rapidement le seuil de saturation de la performance et de l’efficience. Mais les temps accrus d'attente sont souvent plus dus à une mauvaise organisation qu’à des moyens insuffisants et l’augmentation de ressources, sans une gestion rigoureuse du système avec des outils performants, ne résoudra alors pas le problème.
Au Royaume-Uni, le Royal College of Ophthalmologists (RCO) a mené une large enquête visant à proposer de nouvelles méthodes de travail pour répondre aux besoins croissants de soins urgents et à une offre réduite de spécialistes ophtalmologistes formés dans le pays, une tendance par ailleurs générale dans le monde [8].
Au Royaume-Uni, le nombre de patients consultant aux urgences ophtalmologiques a fortement augmenté depuis environ 10 ans, et ce malgré un accroissement de 71 % des effectifs médicaux aux urgences ophtalmologiques, passant de 3 183 en 2002 à 5 437 en 2012 ; les délais d'attente augmentent dépassant l’objectif fixé à 4 heures [9, 10]. Au Moorfields Eye Hospital à Londres, le nombre de consultants aux urgences ophtalmologiques a doublé en 10 ans dépassant les 100 000/an entre 2015 et 2016. La tendance française est identique (voir chapitre 2.2 ). Cette tendance générale dans les centres d'ophtalmologie serait due au vieillissement des populations dans les pays industrialisés, à l’augmentation de pathologies liées à l’âge accessibles à des traitements au long cours requérant des suivis et possiblement des soins urgents (comme la DMLA), à une meilleure information des patients et des médecins référents quant aux signes ophtalmologiques urgents [11]. La crainte de perdre la vue chez les personnes âgées, dont la durée de vie augmente et l’état de santé se maintient, est également un motif du nombre croissant des consultations [12]. On note toutefois la modification des styles de vie en milieu urbain conduisant à une réduction des jeux en plein air et des risques d'accidents par blessure, les enfants et adolescents passant plus de temps devant des écrans qu’à la pratique d'activités violentes ou dangereuses. Les méthodes de prévention en milieu professionnel devraient également réduire les accidents oculaires du travail (lunettes pour la soudure, par exemple), mais cela reste marginal.
Le nombre croissant de patients aux urgences peut dans certains cas résulter de la disparition progressive des consultations générales dans les services d'ophtalmologie au profit de consultations hyperspécialisées conduisant à assurer le suivi « post-urgence » aux urgences même. Ce sont les médecins en formation qui souvent convoquent les patients aux urgences pour leur permettre de suivre l’évolution de la pathologie et juger de la qualité de leur traitement. Cette intention louable mais génératrice de dysfonctionnements majeurs peut être remplacée par une réorganisation des circuits patients permettant aux médecins en formation de disposer de consultations de suivi post-urgence.
Mais les analyses du nombre d'urgences distinguant « suivi » et « nouveaux cas » montrent malgré tout une augmentation des nouveaux cas, confirmant que la tendance à l’accroissement est réelle [13].
Un autre motif de l’augmentation du nombre de patients consultant aux urgences est la réduction du nombre d'ophtalmologistes généralistes et la difficulté d'obtention de rendez-vous dans des délais raisonnables en ville ou dans les hôpitaux. Cette diminution est observée dans plusieurs pays en Europe, elle est liée à des numerus clausus limitant l’accès aux spécialités et qui sont inférieurs au nombre de départs en retraite. Au Royaume-Uni, comme dans la plupart des pays anglo-saxons, une partie des patients est gérée uniquement par des optométristes ou des généralistes, voire par des pharmaciens mais cela ne semble pas répondre au besoin de soins ophtalmologiques urgents [14, 15]. Enfin, les comportements des individus se modifient et les sociétés industrialisées évoluent vers la réduction du temps de travail, une tendance observée aussi chez les médecins.
L’enquête menée au Royaume-Uni a mis en évidence par ailleurs que les médecins juniors qui donnent des consultations aux urgences actuellement tendent à être plus lents, mettant en moyenne 17 % de temps en plus que leurs prédécesseurs du même âge à examiner les patients [10]. Cela serait dû à une crainte accrue de faire des erreurs mais aussi à une mise à disposition davantage d'appareils d'examens complémentaires. Cette tendance est générale et si les méthodes d'examens automatisées facilitent et accélèrent l’examen ophtalmologique de base, la réalisation fréquente d'autres examens, tels que la tomographie à cohérence optique ou le champ visuel, allonge le temps de consultation. Enfin, l’utilisation du dossier patient informatisé peut également augmenter la durée de la consultation de façon significative selon les systèmes utilisés, en particulier au début de sa mise en place.
La plupart des hôpitaux et cliniques font assurer les urgences par des médecins en formation, parfois même par des médecins à peine formés. La présence de médecins seniors dans l’établissement, même quand ils assurent alternativement par rotation la supervision, ne suffit pas à répondre aux demandes des jeunes médecins confrontés à de multiples pathologies. Sans aborder les problèmes éthiques et de qualité des soins de ces pratiques, c’est une source fréquente d'augmentation significative des délais d'attente. Comme dans tous les domaines de la médecine, la pratique de la médecine d'urgence nécessite une formation, un entraînement et une expérience. La « seniorisation » des urgences a été préconisée et réalisée en France dans plusieurs spécialités, dont la pédiatrie depuis le rapport sur les urgences du Pr Steg il y a plus de 20 ans [16]. Une réflexion s’impose au niveau politique pour permettre la formation, la fidélisation et l’intérêt de médecins dédiés aux urgences ophtalmologiques dans les grands centres.
Certains centres choisissent d'assurer des consultations d'urgence en binôme avec un jeune médecin en formation et un senior, forçant tous les spécialistes à assurer des consultations d'urgence chaque semaine (par exemple, le Moorfield Eye Hospital à Londres). L’alternative est d'engager des médecins ophtalmologistes généralistes qui assurent les urgences et forment les jeunes ophtalmologistes.
Les déficiences organisationnelles sont la principale cause de délais d'attente non contrôlés. Nous ne reviendrons pas sur les multiples et non exhaustives mesures d'amont qui permettent la gestion efficiente des urgences et le maintien d'un délai d'attente compatible avec les objectifs fixés. Une fois les objectifs fixés, les moyens adéquats doivent être déployés pour permettre qu’ils soient atteints. Certains centres interrogés dans l’enquête au Royaume-Uni ont déclaré refuser des urgences et les référer aux urgences générales si leur capacité d'accueil risquait d'être dépassée et le délai d'attente d'excéder les 4 heures, montrant les limites du système. Une fois de plus, c’est une décision émanant de la politique de soins et de santé qui dépasse largement les médecins forcés parfois d'assurer les urgences dans des conditions sous-optimales et avec les moyens structurels à leur disposition.
Si l’attente dans une consultation programmée peut être perçue de façon très négative par les patients, ayant des conséquences par ailleurs importantes sur le temps de travail des individus (patients, accompagnants), leur productivité et leur adhésion thérapeutique, l’attente est plus facilement compréhensible pour les patients consultant en urgence. Cependant, comme nous le développons ci-dessous, les délais d'attente non ou mal gérés ne sont pas anodins.
Dans de rares cas, le retard de prise en charge peut conduire à la perte fonctionnelle ou anatomique d'un œil, voire des deux yeux, à une complication oculaire (infectieuse, hémorragique, etc.) mais aussi à la mort du patient (signe oculaire d'une pathologie vasculaire, infectieuse, neurologique, etc.). La mise en place d'une méthode de triage (voir plus loin), la plus sensible possible, assortie d'un rétrocontrôle et d'un système d'amélioration avec revue régulière des cas, doit permettre de réduire voire d'éliminer ces cas. Ils doivent être déclarés comme des incidents médicaux afin d'éviter leur récurrence. La formation optimale du personnel d'accueil est un prérequis au fonctionnement optimal du triage.
Le handicap visuel est le plus redouté de tous les handicaps selon une enquête européenne. La menace d'une perte de la fonction visuelle est de ce fait extrêmement anxiogène pour les patients. L’attente d'un diagnostic ou d'un pronostic peut représenter une souffrance psychologique et des réactions incontrôlées de la part de certains patients, générant de l’agressivité, de la violence, voire la fuite. L’anxiété modifie par ailleurs la perception du temps écoulé, ce qui augmente l’insatisfaction du patient et donne une perception erronée du temps effectivement passé à attendre [17]. L’expérience du patient laisse un souvenir pénible.
Pour les médecins et soignants, le personnel d'accueil et administratifs, le stress psychologique généré par l’incapacité à subvenir aux besoins des patients, le sentiment permanent de submersion et d'insatisfaction d'un travail mal fait, la nécessité de travailler vite et la gestion des patients et des familles constituent une menace à court et long terme pour leur efficience et leur propre santé. Les conséquences sont l’absentéisme, l’abandon des postes aux urgences, le surmenage, voire le burn-out. La souffrance psychologique des personnels aux urgences est largement sous-estimée mais réelle [18, 19]. Une étude récente rapporte que le burn-out des médecins aux urgences est un facteur indépendant et significativement associé à l’augmentation du temps d'attente des patients aux urgences [20]. Par ailleurs, l’insatisfaction des personnels des urgences à accomplir leur travail dans de bonnes conditions est associée à un risque accru de dépression et de burn-out [21]. À l’heure où les ressources humaines se font rares, leur préservation est une priorité que l’ensemble du système de soins doit prendre en compte.
Toutes les études montrent que du point de vue des patients, les délais d'attente aux urgences reflètent au moins en partie la qualité et l’efficience du système de soins [22]. Les indices de satisfaction prennent d'ailleurs en compte ce temps d'attente, conduisant les organisations à fixer des délais seuils et des objectifs [23]. La pression exercée par l’objectif du temps limite d'attente peut conduire à refuser des patients ou à réduire la qualité des soins. Peut-être vaut-il mieux attendre plus longtemps mais être mieux soigné ?
Le recueil des bonnes pratiques organisationnelles, intitulé Réduire le temps de passage aux urgences de la Mission nationale d'expertise et d'audit hospitalier (MeaH) [24] pose la question dans les termes suivants : « pour un service d'urgence, la question importante est la qualité des soins prodigués. Que vaut un quart d'heure de gagné sur le temps de passage aux urgences ? » et conclut de façon suivante : « La médecine d'urgence, c’est le contraire d'une rencontre occasionnelle avec telle ou telle pathologie. Chaque service d'urgence reçoit un nombre suffisant de malades d'une même pathologie pour tenter d'en modéliser sa prise en charge. Aux urgences, on devrait être loin d'une médecine “réactive” et variable d'un soignant à l’autre, d'un malade à l’autre, d'un moment à l’autre. Au contraire, le grand nombre de malades nous pousse à une prise en charge maîtrisée et réfléchie, et en quelque sorte standardisée, autant qu’on puisse le faire. Accepter une réactivité au cas par cas, c’est s’exposer à une variabilité dans la qualité des soins et faire en sorte que le malade soit plus ou moins bien traité selon l’heure ou le soignant. Une telle organisation est clairement non éthique. L’organisation réfléchie, au contraire, même si elle comporte un certain degré de standardisation, conduit à un progrès vers la qualité car c’est s’obliger à réfléchir à l’avance à la façon dont le soin se déroule, à prévoir les difficultés et à organiser les réponses à y apporter. La protocolisation des soins est une recherche de l’efficacité et de la réduction des coûts. D’ailleurs, nous serions bien les seuls professionnels à considérer que peu importe le temps passé à réaliser une tâche donnée ! Réduire le temps de passage est donc un objectif nécessaire et souhaitable pour peu qu’on réponde dans le même temps aux exigences de la qualité des soins. »
Réduire le temps de passage et d'attente aux urgences n’est possible que si c’est un objectif partagé par toute l’équipe des urgences et par la direction médicale et administrative, qui doivent tous être convaincus du bien-fondé de cet objectif. Comme tout projet, cela nécessite d'analyser la situation dans son ensemble, avec ses différents composants (locaux, humains, circuits), de mettre en place un système objectif de mesure des temps de passage aux urgences, de fixer les objectifs, de mettre en place les étapes et mesures organisationnelles puis d'évaluer leurs effets. Plusieurs mesures se sont avérées efficaces, elles sont brièvement résumées ci-dessous.
Le service des urgences est un système complexe et non pas un système compliqué (fig. 2-5-8 ). Un système compliqué est constitué d'un chaînage de cause à effet non ambigu, parfaitement contrôlable depuis l’extérieur. Toute machine à haute précision est compliquée, configurée pour produire des données objectives et sûres (par exemple, la mécanique d'une montre). À l’inverse, un système complexe est constitué de créatures vivantes. Il peut changer à tout moment, est uniquement observable de l’extérieur mais pas contrôlable et non prédictible. Un système complexe peut posséder des éléments qui opèrent de manière standardisée mais leur interaction change continuellement (fig. 2-5-9 ). Il n’est pas possible de contrôler quels patients ni combien vont se présenter au moment où précisément l’un des médecins est au bloc et un(e) infirmier(ière) occupé(e) avec un enfant agité. Dans ce système complexe, l’enjeu est que le diagnostic, le traitement et la prise en charge doivent être des objectifs, précis, sûrs, reproductibles. Pour répondre à l’exigence d'un système constitué d'entités vivantes non contrôlables, il est important de dédier un personnel infirmier à la régulation des flux. L’infirmier(ière) régulateur(trice) est en charge de collecter toutes les informations en temps réel et d'ajuster les variables du système, du point de vue du patient, mais aussi des moyens humains et matériels (trouver un lit, organiser le passage au bloc opératoire, gérer les aspects administratifs avec la famille, informer le médecin senior du manque de médecins juniors, gérer la réception d'un prisonnier, etc.). Le recueil des données sur la fréquentation des urgences avec la plus grande granularité est un support organisationnel permettant d'ajuster et prévoir les moyens disponibles à un niveau plus général, mais ne remplace pas l’infirmier(ière) régulateur(trice) des flux.
Sa mission est :
- –
la seniorisation des urgences par la mise en place de médecins seniors disponibles 24 heures/24 et 7 jours/7 pour superviser les urgences [25–27] ;
- –
la diminution du temps de passage des patients, avec une exigence de qualité accrue. Il est responsable de mettre en place les systèmes de recueil d'informations permettant de piloter et d'améliorer le fonctionnement des urgences et est force de proposition.
La mise en pratique d'un système de triage des patients s’est avérée productive non seulement dans des services d'urgence générale, mais également dans des services d'urgence ophtalmologique. Le but du triage est de discriminer rapidement des catégories de patients dont l’état ophtalmologique et/ou général nécessite des prises en charge différentes (voir plus loin) ; les critères suivants peuvent être pris en compte : ne nécessitant pas une visite en urgence mais plutôt une consultation programmée rapide ; temps d'attente maximal aux urgences ; seniorité de la prise en charge ; soins infirmiers ou médicaux immédiats (lavage oculaire, ablation d'un corps étranger, traitement de la douleur, voie d'abord veineuse, prélèvement sanguin, examen d'imagerie, orientation vers un service de neurologie, etc.). Le triage est une étape essentielle de la gestion du temps d'attente puisque c’est lui qui définit les délais d'attente. Plusieurs méthodes de triage des urgences ophtalmologiques ont été proposées [28–31]. Le triage peut être effectué en premier lieu par le patient lui-même grâce à sa réponse à un questionnaire [32], il peut résulter d'un questionnaire et de paramètres objectifs mesurés par un(e) infirmier(ière) de tri ou un(e) optométriste ou un(e) orthoptiste, ou par le médecin directement. Le choix du système et son implémentation individuelle par chaque centre sont fondamentalement dépendants des personnels disponibles et formés au tri. L’accueil, la réfraction automatisée, la mesure de l’acuité visuelle ainsi que le triage peuvent dans certains cas être réalisés par l’infirmier(ière) de tri [33–35]. Quel que soit le système utilisé, il n’est utile que s’il est discriminant, sensible et assez spécifique pour permettre une véritable stratification de la gravité. Faire un choix de gravité signifie prendre une décision qui, pour le personnel de tri, représente une responsabilité. Cette responsabilité doit être partagée par l’ensemble de l’équipe grâce à une auto-évaluation du système et des boucles d'amélioration dans un souci de gain de performance et non de sanction.
Cette étape est essentielle, c’est elle qui détermine les objectifs de délai, les circuits des patients et oriente d'emblée certains patients vers des consultations de jour dans certains hôpitaux. L’étape du tri est aussi un élément essentiel dans la gestion du temps d'attente, car le patient est déjà pris en charge par un personnel médico-soignant. Pour lui, le processus a commencé.
Quand le triage a été effectué, l’infirmier(ière) régulateur(trice) des flux doit s’assurer que les patients urgents sont vus dans les délais fixés par le système.
Pour faire face au nombre de patients croissant et à la réduction du nombre des ophtalmologistes, certaines tâches peuvent être déléguées à des infirmier(ière)s mais aussi à des aides-soignant(e)s (délivrance de médicaments, dilatation par goutte) ou à des orthoptistes (examens d'imagerie, acuité visuelle, etc.) à condition que des procédures écrites soient rédigées, que les personnels soient formés et évalués régulièrement de façon traçable pour s’assurer que les compétences peuvent être déléguées. Le succès repose sur l’engagement, la coopération, la communication, la formation et sur des protocoles clairs.
La prise en charge par le patient par un personnel dans un espace de soins marque pour lui le début de la prise en charge et réduit l’impression d'attendre.
Dans de nombreux services des temps très longs peuvent être perdus à la recherche de dossiers de patients connus et suivis dans le service. La gestion informatisée des dossiers résout ces difficultés et réduit les coûts en personnels dédiés à l’archivage. L’informatisation des prescriptions permet également de gagner du temps et de standardiser les prises en charge.
Le nombre de patients pouvant être examinés par un médecin sur une vacation de 4 heures aux urgences est en moyenne de 12 selon l’enquête anglaise mais dépend de l’expérience du médecin [1, 6, 10, 26]. Les jeunes médecins en formation sont beaucoup plus lents que ne l’étaient leurs prédécesseurs quelle que soit la spécialité [36]. Un interne débutant voit en moyenne 7 patients en 4 heures, alors qu’un senior en voit 12 [6]. Réduire le temps d'attente c’est donc principalement déléguer les tâches qui peuvent l’être et utiliser le temps de médecins seniors de façon la plus optimale possible. Quelle que soit l’expertise du médecin, au-delà d'un certain nombre de patients vus, la qualité du soin fourni décroît et le risque d'erreur augmente.
Il y a des tentatives pour gérer certaines urgences par télémédecine (voir encadré 2-5-1 ). Ainsi, pour les patients suivis au long cours pour des maculopathies, des systèmes de tomographie ou de photographie du fond d'œil automatisés permettent de télétransmettre les images au médecin qui peut immédiatement décider si le patient doit consulter ou pas [37, 38]. La télémédecine est actuellement davantage envisagée comme une alternative dans les régions où la densité médicale est très faible et quand les patients sont peu mobiles, mais elle pourrait prendre une place croissante dans la gestion et le suivi des patients afin de discriminer les situations d'urgence. L’intelligence artificielle avec ses capacités d'implémentation et d'apprentissage des erreurs pourrait devenir un outil essentiel au triage et à l’aide à la prise de décision [39, 40].
Réduire le temps de passage et d'attente aux urgences peut être un objectif prioritaire ou pas. En revanche, gérer le temps d'attente est une obligation.
Plus que le délai d'attente aux urgences, que les patients peuvent comprendre, car ils perçoivent intuitivement qu’il s’agit d'un système complexe, c’est le manque d'information quant à l’attente, sa durée, son motif, etc. qui est intolérable [41]. Les études montrent que les plaintes des patients concernent davantage le manque d'information pendant l’attente que l’attente elle-même et que la satisfaction est proportionnelle à la qualité et quantité d'information reçue [42].
Du point de vue du patient, l’anxiété générée par l’attente du diagnostic est considérablement majorée par l’anxiété de ne pas savoir combien de temps il va attendre et sur quels critères les patients sont priorisés. À cette anxiété s’ajoute un sentiment de désordre et de gestion aléatoire.
La prise en charge immédiate par l’infirmier(ière) de tri constitue pour le patient le début du soin, son classement dans une catégorie d'urgence qui lui est expliqué permet de laisser le choix d'attendre ou si le degré d'urgence est minime de reprendre en rendez-vous électif.
Idéalement, la création de « zones d'attente » différentes selon les différents degrés d'urgence permet au patient de comprendre pourquoi son temps d'attente est différent de celui d'autres patients et d'estimer le nombre de patients dans sa catégorie qui seront vus avant lui [43].
Enfin l’affichage en temps réel des temps d'attente en fonction des catégories issues du tri est un élément essentiel tant à la gestion des flux qu’à l’information due aux patients. Les études ont confirmé que l’anxiété diminue avec une communication transparente [44]. Pour que les équipes soignantes puissent informer les patients, elles doivent disposer elles-mêmes des informations : où se trouve le médecin ? Pourquoi il n’est pas à son poste ? Quel avis il est allé chercher ? Qui remplace le médecin quand il doit assurer un acte de suture ou de chirurgie ? Qui sont les médecins de permanence ? etc. Force est de constater que l’information ne circule pas toujours de façon optimale au sein des équipes médico-soignantes.
Une fois le délai d'attente prévisionnel estimé selon les catégories et l’affluence, les patients pour lesquels le temps dépasse l’heure pourraient recevoir un émetteur leur permettant de s’éloigner mais de recevoir un signal quand le patient qui le précède est examiné. Ces systèmes peu coûteux sont utilisés dans la restauration et devraient être utilisés aux urgences. L’utilisation de SMS est une option qui évite la surcharge des salles d'attente.
Pendant les périodes d'attente, les patients peuvent répondre à des questionnaires si leur état de santé et visuel le leur permet et devraient recevoir des informations audiovisuelles sur la façon d'instiller des gouttes, l’organisation des soins aux urgences, etc. Ces mesures ont démontré leur efficacité pour réduire le degré d'anxiété des patients [45].
Les moyens audiovisuels actuels permettent de diffuser à moindre coût des images et des musiques apaisantes qui occupent et détendent les patients. La visualisation d'œuvre d'art a un effet positif sur l’agressivité des patients aux urgences [46]. La dispensation d'eau particulièrement en cas de forte chaleur doit être envisagée.
Selon les systèmes et organisation de soins, les urgences ophtalmologiques pédiatriques sont gérées par les urgences d'ophtalmologie ou par les urgences pédiatriques qui font appel à des ophtalmologistes pédiatriques de réserve. Cette dernière option est idéale, car elle permet d'assurer un environnement adapté à l’enfance pour l’accueil, l’attente et les spécificités de la pédiatrie. À l’heure où la population âgée devient plus nombreuse et plus fréquente en milieu d'urgence, une réflexion peut être menée pour prendre en charge des urgences gériatriques générales et éventuellement spécialisées. Plusieurs études montrent que le temps d'attente aux urgences est plus long pour les personnes plus âgées (> 65 ans) du fait de comorbidités, de recours à plusieurs spécialistes, d'organisation des soins plus complexe [47, 48]. Pourtant le temps de passage devrait être réduit dans ces populations plus fragiles tant sur le plan physique que psychologique.
Dans la plupart des systèmes de triage, l’âge et les comorbidités sont utilisés comme facteur de « gravité » permettant de classer ces patients dans des catégories d'attente plus courte. Durant les périodes d'attente, les enfants doivent pouvoir bénéficier d'espaces dédiés, de jeux et de livres adaptés. La gestion de l’anxiété parentale fait partie intégrante du travail des personnels d'accueil.
En l’absence de possibilités de communication avec les patients se présentant aux urgences (pas d'interprète, pas d'accompagnants, etc.), il est recommandé de limiter le temps d'attente pour réduire l’anxiété et des réactions non prévisibles.
La gestion du temps passé aux urgences ophtalmologiques doit être un objectif de tous les services. Pas seulement parce que c’est un indicateur de la qualité et un critère de satisfaction des patients, mais parce que les conséquences d'une organisation déficiente et d'un système en permanent déséquilibre sont lourdes pour les patients mais aussi pour les médecins et les soignants. Il n’y a pas de recette miracle ni universelle, les difficultés pouvant être très différentes selon les localités, les organisations, les moyens et les politiques de santé menées. Fixer les objectifs, travailler avec les équipes et débuter une boucle d'amélioration est déjà un pas franchi vers une satisfaction accrue des équipes de soins et donc des patients.
[1] Cooper ZN, McGuire A, Jones S, Le Grand J. Equity, waiting times, and NHS reforms : retrospective study. BMJ 2009 ; 339 : b3264.
[2] OECD/Who/Eurostat. A system of health accounts. Paris ; 2011.
[3] Dixon H, Siciliani L. Waiting-time targets in the healthcare sector : how long are we waiting ? J Health Econ 2009 ; 28 : 1081‑98.
[4] Hansson J, Tolf S, Ovretveit J, et al. What happened to the no-wait hospital ? A case study of implementation of operational plans for reduced waits. Qual Manag Health Care 2012 ; 21 : 34‑43.
[5] Viberg N, Forsberg BC, Borowitz M, Molin R. International comparisons of waiting times in health care--limitations and prospects. Health Policy 2013 ; 112 : 53‑61.
[6] Welfare AIoHa. Hospital performance : emergency department waiting times. IAIo‑ HaW Editor ; 2017.
[7] Standing Committee of the Hospitals of the EU. Waiting lists and waiting times in health care – managing demand and supply. April 2001. En ligne : http://www.hope.be/ wp-content/uploads/2015/11/60_2001_HOPE-REPORT_Waiting-lists-and-waiting-timesin- health-care-managing-demand-and-supply.pdf
[8] Resnikoff S, Felch W, Gauthier TM, Spivey B. The number of ophthalmologists in practice and training worldwide : a growing gap despite more than 200,000 practitioners. Br J Ophthalmol 2012 ; 96 : 783‑7.
[9] NHS Digital. Focus on accident and emergency. 2013. En ligne : http://content.digital. nhs.uk/catalogue/PUB13040/acci-emer-focu-on-2013-rep-V2.pdf
[10] MacEwen C, Buchan J. The way forward : options to help meet demand for the current and future care of patients with eye disease. En ligne : https://www.rcophth.ac.uk/ wp-content/uploads/2015/10/RCOphth-The-Way-Forward-Glaucoma-300117.pdf
[11] Keunen JE, Verezen CA, Imhof SM, et al. Increase in the demand for eye-care services in the Netherlands 2010‑2020. Ned Tijdschr Geneeskd 2011 ; 155 : A3461.
[12] Hau S, Ioannidis A, Masaoutis P, Verma S. Patterns of ophthalmological complaints presenting to a dedicated ophthalmic Accident & Emergency department : inappropriate use and patients’ perspective. Emerg Med J 2008 ; 25 : 740‑4.
[13] Siempis T. Urgent eye care in the uk increased demand and challenges for the future. Med Hypothesis Discov Innov Ophthalmol 2014 ; 3 : 103‑10.
[14] Parkins DJ, Curran R, Pooley JE, Ryan B. The developing role of optometrists as part of the NHS primary care team. Optom Pract 2014 ; 15 : 177‑84.
[15] Sheldrick J, Wilson A, Vernon S, Sheldrick C. Management of ophthalmic disease in general practice. Br J Gen Pract 1993 ; 43 : 459‑62.
[16] Steg A. Rapport sur la médicalisation des urgences. Commission nationale de restructuration des urgences ; 1995 ; 105 p. En ligne : http://documentation.fhp.fr/ documents/3746R.pdf
[17] Thompson DA, Yarnold PR, Adams SL, Spacone AB. How accurate are waiting time perceptions of patients in the emergency department ? Annals of Emergency Medicine 1996 ; 28 : 652‑6.
[18] Escribà-Agüir V, Martín-Baena D, Pérez-Hoyos S. Psychosocial work environment and burnout among emergency medical and nursing staff. International Archives of Occupational and Environmental Health 2006 ; 80 : 127‑33.
[19] Ilić IM, Arandjelović MŽ, Jovanović JM, Nešić MM. Relationships of work-related psychosocial risks, stress, individual factors and burnout – Questionnaire survey among emergency physicians and nurses. Med Pr 2017 ; 68 : 167‑78.
[20] De Stefano C, Philippon AL, Krastinova E, et al. Effect of emergency physician burnout on patient waiting times. Intern Emerg Med 2017.
[21] Tarcan M, Hikmet N, Schooley B, et al. An analysis of the relationship between burnout, socio-demographic and workplace factors and job satisfaction among emergency department health professionals. Applied Nursing Research 2017 ; 34 : 40‑7.
[22] Thompson DA, Yarnold PR, Williams DR, Adams SL. Effects of actual waiting time, perceived waiting time, information delivery, and expressive quality on patient satisfaction in the emergency department. Ann Emerg Med 1996 ; 28 : 657‑65.
[23] Soremekun OA, Takayesu JK, Bohan SJ. Framework for analyzing wait times and other factors that impact patient satisfaction in the emergency department. The Journal of Emergency Medicine 2011 ; 41 : 686‑92.
[24] MeaH, ANAP. Réduire le temps de passage aux urgences. Tome 3. 2007‑2008. En ligne : http://www.anap.fr/ressources/publications/detail/actualites/reduire-les-temps-depassage- aux-urgences-tome-3/
[25] McNeill G, Brahmbhatt DH, Prevost AT, Trepte NJ. What is the effect of a consultant presence in an acute medical unit ? Clin Med (Lond) 2009 ; 9 : 214‑8.
[26] White AL, Armstrong PA, Thakore S. Impact of senior clinical review on patient disposition from the emergency department. Emerg Med J 2010 ; 27 : 262‑5, 296.
[27] Christmas E, Johnson I, Locker T. The impact of 24 h consultant shop floor presence on emergency department performance : a natural experiment. Emerg Med J 2012 ; 30 : 360‑2.
[28] Rossi T, Boccassini B, Iossa M, et al. Triaging and coding ophthalmic emergency : the Rome Eye Scoring System for Urgency and Emergency (RESCUE) : a pilot study of 1,000 eye-dedicated emergency room patients. Eur J Ophthalmol 2007 ; 17 : 413‑7.
[29] Rossi T, Boccassini B, Cedrone C, et al. Testing the reliability of an eye-dedicated triaging system : the RESCUE. Eur J Ophthalmol 2008 ; 18 : 445‑9.
[30] Bourges JL, Boutron I, Monnet D, Brezin AP. Consensus on Severity for Ocular Emergency : The BAsic SEverity Score for Common OculaR Emergencies [BaSe SCOrE]. J Ophthalmol 2015 ; 2015 : 576983.
[31] AlSamnan MS, Mousa A, Al-Kuwaileet S, AlSuhaibani AH. Triaging self-referred patients attending ophthalmic emergency room. Saudi Med J 2015 ; 36 : 678‑84.
[32] Vartsakis G, Fahy G. The profile of patients attending a triaged eye emergency service. Ir J Med Sci 2014 ; 183 : 625‑8.
[33] Ilango B, McGalliard J, Hughes A. The role of nurse practitioners in a primary care eye clinic. Accident and Emergency Nursing 2000 ; 8 : 42‑5.
[34] Buchan JC, Saihan Z, Reynolds AG. Nurse triage, diagnosis and treatment of eye casualty patients: a study of quality and utility. Accident and Emergency Nursing 2003 ; 11 : 226‑8.
[35] Kirkwood BJ, Pesudovs K, Loh RS, Coster DJ. Implementation and evaluation of an ophthalmic nurse practitioner emergency eye clinic. Clinical & Experimental Ophthalmology 2005 ; 33 : 593‑7.
[36] Armstrong PA, White AL, Thakore S. Reduced productivity among junior trainees in the emergency department and the impact on senior clinicians. Emergency Medicine Journal 2010 ; 27 : 97‑9.
[37] Gillam SJ, Ball M, Prasad M, Dunne H, Cohen S, Vafidis G. Investigation of benefits and costs of an ophthalmic outreach clinic in general practice. Br J Gen Pract 1995 ; 45 : 649‑52.
[38] Kelly SP, Wallwork I, Haider D, Qureshi K. Teleophthalmology with optical coherence tomography imaging in community optometry. Evaluation of a quality improvement for macular patients. Clin Ophthalmol 2011 ; 5 : 1673‑8.
[39] Belle A, Kon MA, Najarian K. Biomedical informatics for computer-aided decision support systems : a survey. ScientificWorldJournal 2013 ; 2013 : 769639.
[40] Zlotnik A, Alfaro MC, Perez MC, et al. Building a decision support system for inpatient admission prediction with the manchester triage system and administrative check-in variables. Comput Inform Nurs 2016 ; 34 : 224‑30.
[41] Shah S, Patel A, Rumoro DP, et al. Managing patient expectations at emergency department triage. Patient Experience Journal 2015 ; 2 : 31‑44.
[42] Emergency department pulse report : patient perspectives on American health care. Press Ganey Associates, 2010. En ligne :http://www.osuem.com/education/journal‑ Club/2010_ED_Pulse_Report.pdf
[43] McMillan JR, Younger MS, DeWine LC. Satisfaction with hospital emergency department as a function of patient triage. Health Care Manage Rev 1986 ; 11 : 21‑7.
[44] Ekwall A. Acuity and anxiety from the patient’s perspective in the emergency department. J Emerg Nurs 2013 ; 39 : 534‑8.
[45] Corbett SW, White PD, Wittlake WA. Benefits of an informational videotape for emergency department patients. Am J Emerg Med 2000 ; 18 : 67‑71.
[46] Nanda U, Chanaud C, Nelson M, et al. Impact of visual art on patient behavior in the emergency department waiting room. J Emerg Med 2012 ; 43 : 172‑81.
[47] Freund Y, Yordanov Y, Vincent-Cassy C, et al. Old patients wait longer in the emergency department. J Am Geriatr Soc 2012 ; 60 : 1592‑3.
[48] Vegting IL, Alam N, Ghanes K, et al. What are we waiting for ? Factors influencing completion times in an academic and peripheral emergency department. Neth J Med 2015 ; 73 : 331‑40.
A. PISON, J.-L. BOURGES
-
Le triage consiste à définir un degré de priorité pour une DSNP parmi les autres.
-
Prioriser une DSNP n’est utile que si une forme d'attente avant la prise en charge s’impose. En l’absence d'affluence et/ou d'attente, le triage est inutile car l’ordre de présentation est celui de la prise en charge.
-
Le triage des DSNP résulte d'une évaluation effectuée par le trieur à l’accueil du patient. Elle se fonde sur son expérience, parfois augmentée de formulaires de tri d'urgence en ophtalmologie, dont aucun n’est totalement consensuel à ce jour.
-
Plus d'un cas sur dix pose un problème diagnostique à l’ophtalmologiste lui-même.
-
La DSNPO est qualifiée d'item d'urgence seulement si son délai de prise en charge est incompatible avec une programmation.
Le triage représente l’action d'opérer un tri en utilisant un système spécialisé dans le type de tri que l’on effectue. Le degré d'urgence d'une affection oculaire conditionne le délai et les moyens entrepris pour sa prise en charge. Il est pertinent d'effectuer un triage des patients lorsque l’affluence des DSNPO entraîne un délai significatif pour accéder à la ressource de soins (soin infirmier, examen médical, prise en charge ; fig. 2-5-10 ). Le délai devient significatif lorsqu’il est susceptible d'influer sur un pronostic. Il faut alors opérer un tri spécialisé des patients, des motifs de DSNPO et finalement des items d'urgence à prendre en charge. Pour cela, il est possible d'organiser le triage en utilisant les connaissances expérientielles des collaborateurs administratifs ou des soignants. Cette expertise est complétée le cas échéant de guides d'orientation, de formulaires voire de systèmes élaborés de triage des urgences. Le triage des affections oculaires prises en charge de manière non programmée peut être appliqué aux différents échelons de l’accueil du patient. Dès l’instant où le patient demande l’intervention d'un tiers dans la prise en charge non programmée de son affection oculaire jusqu’au niveau le plus élaboré de la chaîne de soins, il s’opère un triage décisionnel. Il est plus ou moins sophistiqué, plus ou moins formalisé. Il oriente le patient sélectivement pour conditionner sa prise en charge. À chaque niveau d'accueil du patient correspondent une étape de triage et une décision (fig. 2-5-11 ). Ce peut être un conseil, la dispensation d'un élément thérapeutique, la priorisation ou non d'un rendez-vous, un acte d'orientation, un acte de soin, etc. Intuitivement, il est évident que la décision de tri et d'orientation est un point essentiel tant pour la qualité du soin que pour le pronostic de l’affection. Elle fait pourtant rarement l’objet d'une formalisation, d'un consensus et encore moins de validations conduites scientifiquement. Des guides d'orientation destinés aux secrétaires, des systèmes de tri infirmier ont été développés pour les urgences générales. Ils aident à traiter rapidement les urgences vitales. À côté de cela, très peu ont été proposés dans le domaine de l’ophtalmologie et encore moins ont été validés scientifiquement. Au-delà d'une validation du triage par ses auteurs (validation interne), il convient dans l’idéal de s’assurer que le triage considéré est applicable partout (validation externe). Ce sous-chapitre décrit les différentes aides au triage et les systèmes de triage ophtalmologiques existants. Il présente leurs avantages et inconvénients, ainsi que les possibilités d'amélioration future. Enfin, la finalité du triage étant la prise en charge du patient, il aborde la prise en charge d'aval qui en découle.
Un patient, estimant son propre niveau d'urgence ophtalmologique, peut de lui-même décider de : s’automédiquer (1), demander conseil à un pharmacien (2), à un soignant non médical (infirmerie, secrétariat médical) (3), à un médecin généraliste, urgentiste ou ophtalmologiste (4). À chaque recours, une prise en charge partielle ou totale peut être administrée. Le recours à une structure d'accueil d'urgence omnipraticienne ou ophtalmologique (5), niveau de recours le plus élaboré et le plus coûteux, est accessible à n’importe quel moment. Chaque étape génère un triage plus ou moins formalisé optant pour une gestion autonome ou déléguée.
Le triage comprend plusieurs étapes déterminantes (fig. 2-5-12). Le recueil des éléments d'anamnèse note en particulier les symptômes, le contexte d'apparition de ceux-ci, ainsi que leur début et leur progression. Ensuite, l’identification des signes physiques d'examen, orientés par l’étape précédente, peut se compléter par une étape d'exploration complémentaire. Cela construit la proposition diagnostique qui formalise l’item d'urgence en rapport avec la DSNPO. Il convient d'attribuer à l’item d'urgence un niveau de sévérité, qui est quantifié d'une manière consensuelle si possible [1]. Le triage de priorisation peut alors être pratiqué, adapté à l’ophtalmologie. Les prises en charge thérapeutiques et du contexte sont alors enclenchées dans un délai optimal et avec les moyens nécessaires. Finalement, l’orientation d'aval termine la prise en charge dans le contexte du soin d'urgence immédiat. Le triage aide à ce que :
- –
un item d'urgence prioritaire soit reconnu dans un délai optimal parmi le flux des DSNPO ;
- –
un délai approprié soit respecté, par exemple pour l’évacuation vers une structure de soins ciblée (hospitalisation, bloc chirurgical, etc.), un contrôle ou une simple autosurveillance.
Depuis le début des années 1990, de nombreux pays ont introduit et développé des systèmes de triage aux urgences générales. La plupart comportent cinq échelles de tri. Les plus connus sont l’ Australian Triage Scale (ATS), le Canadian Emergency Department Triage and Acuity Scale (CTAS), le Manchester Triage Scale (MTS) et l ’Emergency Severity Index (ESI). Tous ces systèmes de tri reposent sur l’infirmier(ière) organisant l’accueil (IOA) – auparavant appelées infirmier(ière) d'accueil et d'orientation – qui réalise un interrogatoire et mesure les fonctions vitales [2]. Le score CIMU est un système de triage français internationalisé non spécialisé qui a fait l’objet d'une validation interne et externe (tableau 2-5-1 ) [3, 4]. Bien évidemment, il s’attache à prioriser les menaces immédiates des fonctions vitales. De ce fait, il est inadapté au triage en ophtalmologie. Même si quelques items d'urgence d'ophtalmologie peuvent parfois engager le pronostic vital, il n’en existe pas qui le menace de manière assez imminente pour représenter une détresse vitale majeure instantanée.
| Tri | Situation | Risque d'aggravation | Délais d'intervention |
|---|---|---|---|
| 1 | Détresse vitale majeure | Dans les minutes | Infirmier(ière) < 1 min Médecin < 1 min |
| 2 | Atteinte patente d'un organe vital ou lésion traumatique sévère (instabilité patente) | Dans les prochaines heures | Infirmier(ière) < 1 min Médecin < 20 min |
| 3 | Atteinte fonctionnelle ou lésionnelle instable ou complexe (instabilité potentielle) | Dans les 24 heures | Médecin < 90 min |
| 4 | Atteinte fonctionnelle ou lésionnelle stable | Non | Médecin < 120 min |
| 5 | Pas d'atteinte fonctionnelle ou lésionnelle évidente | Non | Médecin < 240 min |
* Le document complet est consultable à l'adresse suivante http://www.triage-urgence.com/downloads/Cimu_descrip_gen_tri.pdf .
En SUO, comme aux urgences générales, un système de triage fiable et validé, dédié à l’ophtalmologie, pourrait améliorer la prise en charge et le délai d'attente aux urgences ophtalmologiques. Les acteurs du triage de première ligne des DSNPO sont variés (fig. 2-5-11 ). Le patient peut de lui-même décider de qui évaluera la priorisation de son affection en s’adressant à un pharmacien, en contactant un médecin généraliste, ou en s’adressant à son ophtalmologiste. Dans les cabinets de ville, le triage des urgences ophtalmologiques est réalisé par le(la) secrétaire médical(e) généralement formé(e) par ses acquis de l’expérience, ses collègues, par l’ophtalmologiste lui-même et/ou par une formation formalisée comme celle du Syndicat national des ophtalmologistes français (SNOF) par exemple ( e-learning
3. Voir : https://youtu.be/orK0wlXQel4 .
, séances de congrès, etc.). Il peut aussi s’adresser directement à une SU généraliste ou ophtalmologique, où le triage est généralement effectué par un agent organisant l’accueil. Il s’agit habituellement d'un soignant du corps infirmier. Il peut être médecin. À chaque recours, une prise en charge partielle ou totale peut être déclenchée.
Le recours à une structure d'accueil d'urgence omnipraticienne ou ophtalmologique, niveau de recours le plus élaboré et le plus coûteux, est accessible à n’importe quel moment, pour n’importe quelle DSNP. C’est une particularité française. Dans certains pays, comme le Royaume-Uni, le triage infirmier et la prise en charge des patients simples peuvent être confiés à un(e) infirmier(ière) spécialement formé(e) dans le cadre d'une délégation de tâches. En effet, en 1998, Banerjee et al. ont réalisé une étude prospective aux urgences ophtalmologiques d'un hôpital anglais portant sur 301 patients (2 semaines) qui ont été triés et pris en charge par un(e) IOA [5]. Cinquante patients (16,6 %) ont été également vus par un ophtalmologiste, qui a approuvé le diagnostic posé chez tous les patients, et la prise en charge dans 96 % des cas. Il faut cependant garder à l’esprit que la fiabilité diagnostique d'un ophtalmologiste ne serait que de 83 % au regard du diagnostic final, établi a posteriori [6].
Buchan et al. ont confirmé en 2003 la même expérience dans un centre ophtalmologique de Londres sur 1 976 patients, dont 440 (22 %) avaient été examinés uniquement par l’IOA formé(e) à l’examen biomicroscopique [7]. Huit patients (2,5 %) avaient reconsulté sans rendez-vous, mais cela n’aurait pas pu être évité par la consultation médicale. Cinq ans plus tard, Buchan et al. ont répété l’expérience, et 17 % des patients avaient été examinés uniquement par l’IOA [8]. Cependant, 3 patients avaient reconsulté sans rendez-vous à cause d'une erreur de diagnostic ou d'une prise en charge non optimale. Les auteurs ont alors été amenés à modérer leurs propos concernant cette délégation de tâches et ont réaffirmé la nécessité d'une formation continue avec un système de signalement des incidents, afin d'améliorer ce système.
Dans la littérature, la proportion de DSNPO examinées uniquement par l’infirmier(ière) varie de 17 à 69 % [7, 9, 10].
De même, en 2007, Hau et al. [11] ont évalué la concordance entre un optométriste et un ophtalmologiste en ce qui concerne le plan de prise en charge de 150 patients pris au hasard en SUO. La concordance entre l’optométriste et l’ophtalmologiste était de 89,3 % pour le diagnostic primaire et de 79,3 % pour le plan de prise en charge. Aucune pathologie menaçant la vision n’avait été méconnue par l’optométriste. Cependant, les effectifs et la puissance de cette étude prêtent à discussion lorsqu’on sait qu’un quart des urgences représente moins de 1 % des items généraux vus aux urgences ophtalmologiques (voir chapitre 2.3 ). Même si ce système semble être intéressant dans le cadre des urgences, les études n’ont pas formellement mis en évidence l’absence de risque pour le patient.
Au Brésil, un dispositif télémédical de triage ophtalmologique a été testé afin d'épargner l’adressage en SUO distante [12]. Il s’agissait ici de pratiquer un triage spécialisé sans spécialiste sur site. L’originalité de cette approche résidait dans l’outil utilisé plus que dans le logigramme de tri lui-même. Ici, le but était d'augmenter le niveau d'expertise de celui qui implémente le triage, plutôt que de guider le triage en encadrant une décision moins experte. La concordance entre le diagnostic télédistant de l’ophtalmologiste et celui fait en examen direct était de 95 %%. Ce dispositif aurait épargné 14 % de passages en structure spécialisée ophtalmologique.
D’après Fenton et al. [13], environ 70 % des patients se présentant aux urgences générales ne présentent pas de pathologie urgente et pourraient être traités en centre de consultation ambulatoire.
Une étude s’est intéressée à la prise en charge des DSNPO au sein des urgences générales de trois centres hospitaliers français [14]. Les objectifs étaient d'observer le flux des patients consultant dans ce contexte et de questionner les urgentistes sur leur pratique de l’ophtalmologie et leurs habitudes d'orientation, à l’aide d'un questionnaire auto-administré. L’étude a recruté 781 patients ayant une DSNPO accueillies en SU générale. La proportion moyenne des consultations d'ophtalmologie par rapport à l’ensemble des autres motifs de consultation était de 2 %%. Les motifs de consultation étaient, par ordre croissant : agression 2 %, brûlure chimique 4 %, paupière et orbite 6 %, neuro-ophtalmologie 12 %, traumatisme 20 %, rougeur oculaire spontanée 23 % et corps étranger extra-oculaire (CEEO) 33 %. Seulement 2 % des patients étaient finalement orientés vers une admission en ophtalmologie (hospitalisation conventionnelle). Au total, 62 % des patients étaient orientés vers l’ophtalmologiste de l’établissement, tandis que 15 % suivaient cette orientation le lendemain.
Avec un taux de réponse de 73 % sur les trois établissements ainsi que deux centres privés de proximité, le questionnaire renseignait sur les habitudes de triage des médecins urgentistes locaux. Parmi eux, 68 % demandaient souvent ou systématiquement l’avis de l’ophtalmologiste pour les aider dans la prise en charge des urgences ophtalmologiques. De plus, 77 % déclaraient conseiller souvent ou systématiquement au patient de revoir un ophtalmologiste dans les suites de leur consultation aux urgences. L’obtention d'un avis d'ophtalmologiste paraissait facile à très facile à 89 % des médecins urgentistes en journée, mais plutôt difficile voire impossible pour 48 % d'entre eux en soirée. Neuf praticiens sur dix se disaient intéressés par davantage de formations en ophtalmologie, 69 % préférant la forme de stages pratiques au sein du service d'ophtalmologie.
Les trois centres observés dans cette étude fonctionnaient différemment, et une homogénéisation des pratiques semblait possible. Cet exemple illustre pourquoi le service d'aide médicale urgent (SAMU)-Urgences de France (assises de l’urgence en 2013) et le référentiel de la Société française de médecine d'urgence (SFMU) [15] exhortent à instaurer de protocoles spécifiques de spécialités, dans le but d'améliorer la prise en charge des patients aux urgences générales. Le centre hospitalier de Caen a, par exemple, créé un logigramme de prise en charge basique d'ophtalmologie aux urgences (annexe 2-5-2 ).
Annexe 2-5-2
Questionnaire d'accueil – Exemple de questionnaire d'accueil d'une DSNPO
Formulaire de triage aux urgences ophtalmologiques Hôtel-Dieu, AP-HP, Paris
Partie 1, clés des codes utilisés pour le triage
Partie 2. Exemple de formulaire d'accueil et d'anamnèse d'urgence ophtalmologique
Logigramme de prise en charge des DSNP d'ophtalmologie en structure d'urgence générale [14]
En fait, il faut identifier parmi toutes les affections motivant les DSNPO celles qui menaceraient le pronostic vital ou un pronostic fonctionnel dans un délai incompatible avec l’offre de soins programmée. Aussi faut-il s’adapter en ophtalmologie à une menace orientée très majoritairement vers un pronostic fonctionnel. En pratique, parmi les scores de triage qui ont été proposés, la graduation du tableau 2-5-2 semble un score simple et pratique qui peut s’appliquer à chaque item d'urgence en ophtalmologie. Le score attaché à chaque item d'urgence dépend aujourd'hui de l’expertise de la personne effectuant le triage et/ou des consignes formalisées dans chaque accueil d'urgence.
En ophtalmologie européenne, l’intérêt d'un accueil des urgences spécialisées est communément admis. Hors Union européenne, une étude outre-Atlantique montre que les patients sont adressés en soins ophtalmologiques spécialisés par des soignants non-ophtalmologistes (optométriste, généraliste, médecin urgentiste) avec un diagnostic présupposé qui se révèle exact dans 45 % des cas seulement [6]. Le prédiagnostic de l’ophtalmologiste adressant ne se révèle par la suite être exact que dans 83 % des cas. Plus d'un cas sur dix pose donc un problème diagnostique au spécialiste. Tout aussi préoccupant, le prédiagnostic du soignant non-ophtalmologiste se révèle tout à fait inexact dans un tiers des cas. Heureusement, les items d'urgence nécessitant une prise en charge sans délai sont de très faible fréquence en permanence de soins de nuit profonde. De ce fait, il est admis qu’en l’absence de SUO dédiée, un passage par les SU générales pourrait être acceptable à ces heureslà [16].
Le flux des DSNPO correspond à des items d'urgence vraie qui s’étoffent de demandes pouvant être différées sans perte de chance pour le patient. En ce sens et en amont de l’accueil d'urgence, il est possible d'informer les patients des signes d'alerte ophtalmologiques. L’information peut porter à l’inverse sur les conditions qui ne justifient pas a priori d'une prise en charge urgente. Cela permet d'augmenter la pertinence de la demande de soin. L’exemple d'un tel document utilisé au CHU de Brest est proposé au chapitre 1 , dans l’annexe 1-2-3 (voir aussi annexe 1-2-4 ). Initialisant l’étape de prise en charge non programmée, le triage peut débuter par un questionnaire orienté, interrogeant le patient au sujet de sa DSNPO. Il s’agit du document de triage le plus simple. Il se focalise sur la première étape du triage : l’anamnèse (fig. 2-5-12 ). L’ annexe 2-5-2 renseigne sur des exemples de questionnaires simples qui formalisent l’anamnèse. Ils sont peu discriminants pour le délai de priorisation ou l’orientation de prise en charge lorsqu’ils n’attribuent pas de score. Ils ont comme avantages d'accélérer et d'uniformiser l’anamnèse, sans exposer à la méconnaissance d'une urgence vraie. En revanche, ils ne sont pas suffisants pour ajuster les flux de patients vers les structures élaborées de soins ou permettre la priorisation de peu de patients, but ultime du processus complet de triage. Lorsqu’ils attribuent un niveau d'urgence (score, couleur), ils orientent le résultat du triage. Dès lors qu’ils proposent une consigne d'orientation sur la base du niveau d'urgence qu’ils quantifient, ils effectuent le triage dans son ensemble. Ils sont alors plus ou moins rudimentaires, discriminants (spécificité), appropriés (valeur prédictive positive et négative) ou sécuritaires (sensibilité).
Peu de pathologies ophtalmologiques requièrent un traitement immédiat pour éviter un trouble visuel permanent. C’est pourquoi il est important de détecter ces vrais items urgents parmi les pathologies mineures à la symptomatologie parfois bruyante. Une rougeur, une douleur superficielle, une sensation de corps étranger ou un larmoiement simple peuvent amener le patient à consulter et grossir le flux de passage aux urgences ophtalmologiques. La reconnaissance des cas les plus urgents est alors essentielle. Elle dépend d'un système de triage qui se doit d'être le plus efficace possible. Il doit privilégier la sensibilité de dépistage des items dont le pronostic peut être modifié par la prise en charge sans délai. Des documents d'information, d'orientation et de triage sont disponibles en ligne. Quelques exemples non exhaustifs figurent dans l’ annexe 2-5-3 . Un logiciel d'aide à la décision pour le triage infirmier des DSNPO accueillies en SU est en cours d'élaboration à la faculté Paris-Descartes. De plus, les autorités britanniques s’intéressent de près à l’augmentation de la fréquentation des SUO, comme aux moyens d'améliorer la qualité du service (intérêt du triage et orientation en fonction de l’organisation des urgences) [14].
Annexe 2-5-3
Ils informent les patients en situation de DSNPO ou formalisent le triage et/ou l’orientation des DSNPO. Ils sont classés ci-dessous selon le pays de leur conception.
Il n’existe actuellement aucun consensus international concernant le triage des DSNPO. Deux études récentes ont proposé chacune un tel système de triage : l’étude Rome Eye Scoring system for Urgency and Emergency (RESCUE) [17, 18] de Rossi et al. en 2007 puis 2008, et l ’ Ophthalmologic Instrument of Patient Self Triage (ISET) d'Eijik et al. qui est une auto-évaluation du triage par le patient [19].
L’étude RESCUE a été réalisée en trois phases : la première phase d'élaboration était rétrospective incluant 160 936 patients sur 2 ans. Elle permettait la sélection des symptômes le plus souvent associés à une hospitalisation. La deuxième phase de test était prospective incluant 1 000 patients consécutifs, triés par l’IOA à l’aide de quatre symptômes : rougeur, douleur, baisse d'acuité visuelle et risque d'œil ouvert. Les symptômes « rougeur » et « douleur » étaient côtés de 0 à 2, les « baisses d'acuité visuelle » et « risques d'œil ouvert » de 0 à 4, permettant d'obtenir un score de 0 à 12. Le score obtenu permettait de classer les patients en trois catégories : « blanc » de 0 à 3, « vert » de 4 à 7 et « jaune » de 8 à 12. Ensuite, de façon rétrospective, un investigateur effectuait une révision des dossiers en insu, et assignait une couleur au patient (rétrocodage). L’étude a montré une corrélation statistiquement significative entre le triage infirmier réalisé à l’aide du système RESCUE et le rétrocodage effectué par le médecin (p < 0,01).
La troisième phase de validation du RESCUE était rétrospective sur 1 000 patients consécutifs dont le but était de tester la fiabilité du triage. Les patients étaient triés par l’IOA à l’aide du système RESCUE, et les dossiers étaient revus par trois ophtalmologistes investigateurs qui les classaient en urgent (U) ou non urgent (NU). La corrélation entre les deux était étudiée. Sur 1 000 patients, 33 % étaient classés U et 64 % NU. La différence de score RESCUE entre les patients U et NU était statistiquement significative, et il existait une corrélation statistiquement significative entre le triage RESCUE et le caractère U ou NU.
Les diagnostics des patients qui ont été considérés comme non urgents alors qu’ils étaient urgents (faux négatifs) étaient les suivants : 5 patients avaient une diplopie aiguë, 4 avaient un corps étranger cornéen, 3 avaient un décollement de rétine macula appliquée, 2 avaient une plaie conjonctivale, 2 avaient une kératite, 1 patient avait un œdème papillaire, et 1 patient avait un rejet aigu de greffe de cornée. Ce système de triage semble sécuritaire d'après les auteurs, étant donné qu’aucun diagnostic de plaie du globe, d'endophtalmie ou de glaucome aigu n’avait été classé à tort comme non urgent. Parmi les 9,3 % de patients faux positifs (32/346), on retrouvait 8 conjonctivites virales, 8 abrasions cornéennes, 6 migraines ophtalmiques, 4 douleurs post-photokératectomie réfractive, 2 contusions minimes, 2 cataractes séniles, et 2 uvéites antérieures. Cette étude montre des résultats engageants avec une précision du test de 95 % (9,3 % de faux positifs et 2,7 % de faux négatifs), une sensibilité de 90,7 %, une spécificité de 97,2 %, une valeur prédictive positive (VPP) de 94,6 %%, et une valeur prédictive négative (VPN) de 95,2 %. Les patients faux positifs avaient des pathologies mineures avec une symptomatologie bruyante. Dans cette étude, il n’est cependant pas précisé sur quels critères le patient a été classé en U ou NU. La sévérité n’est donc pas évaluée de façon consensuelle. Il s’agit donc d'un système de triage infirmier qui semble efficace mais dont la validation externe est en cours.
Les ophtalmologistes saoudiens du King Saud hospital ont modifié le score RESCUE afin de le rendre plus discriminant pour les patients consultant aux urgences de manière spontanée [20]. Ils ont proposé d'attribuer un score allant de 1 à 4 pour chaque symptôme ou contexte répertorié dans un questionnaire. Les patients étaient triés selon trois catégories en fonction du score total obtenu sur le questionnaire : état ophtalmologique non urgent (0-1), semi-urgent (2-3) ou urgent (> 3). Les patients urgents étaient examinés en priorité, les patients non urgents dans les 45 minutes et les patients semi-urgents avant les patients non urgents. Sur plus de 500 patients, la sensibilité calculée a été de 99 % et la spécificité de 90 % pour discriminer les patients urgents des autres. De fait, la sensibilité était améliorée par rapport aux performances du système RESCUE original, réduisant le risque de méconnaître une urgence ophtalmologique.
Le personnel n’étant pas toujours disponible pour réaliser un tri infirmier (surtout la nuit), l’objectif de cette étude était de tester une méthode de triage réalisée par le patient, et appelée ISET. Cette étude s’est déroulée en deux phases : une première phase permettait l’utilisation et l’amélioration d'un questionnaire remis aux patients, et la seconde phase permettait de tester ce questionnaire amélioré.
Lors de la première phase, un questionnaire papier de 18 items devait être complété par le patient, qui était observé, et le résultat du triage était comparé au tri classique utilisé dans cet hôpital par l’infirmier(ière) ou l’interne en fonction de l’heure et de l’affluence. Ces résultats étaient discutés en table ronde, et un nouveau questionnaire de 11 items sous forme d'un logigramme en résultait.
Une fois le questionnaire complété par le patient, celui-ci recevait un code couleur, chaque couleur correspondant à un temps maximal d'attente : « rouge » (0 minute), « orange » (10 minutes), « jaune » (30 minutes), et « vert » (120 minutes). Ce code couleur était similaire à leur système de tri standard, le « triage assistant ».
La première phase a inclus 296 patients et la seconde, 298 patients.
Lors de la première phase, le prototype ISET avait bien classé les cas très urgents dans 13,6 % des cas, mais il y avait 13,3 % de faux positifs (classés très urgents alors qu’ils étaient peu urgents). Il existait 2,5 % de faux négatifs (7 patients), classés peu urgents alors qu’ils étaient très urgents. Après modification du prototype, il existait une diminution du pourcentage de faux négatifs (1 %) au prix d'une augmentation du pourcentage de faux positifs (20,8 %).
De même, lors de la première phase, la sensibilité et la spécificité étaient de 0,84 chacune, alors qu’au cours de la seconde phase, la sensibilité avait augmenté à 0,94, au prix d'une diminution de la spécificité à 0,76.
Lors de la première phase, il existait une corrélation modérée entre l’ISET et le triage de référence (kappa = 0,54). Lors de la seconde phase de validation, le kappa avait diminué à 0,41, la corrélation restant modérée. Ce déclin peut s’expliquer par le choix d'une plus forte sensibilité entre la première et la seconde phase. Les auteurs ont voulu développer un outil de triage des patients aux urgences ophtalmologiques géré par le patient à l’aide d'un questionnaire papier. Leur objectif était d'obtenir une sensibilité au-dessus de 0,80 et une spécificité au-dessus de 0,70, ce qui a été atteint. Ce système de triage semble intéressant, mais il existe cependant des limites à cette étude :
- –
la référence utilisée dans cette étude était le « triage assistant » réalisé par l’infirmier(ière) de tri ou l’interne en fonction de l’heure, et n’était pas décrite dans l’étude, ni validée ;
- –
les critères permettant de classer les patients en « très urgent » ou « peu urgent » ne sont pas décrits dans l’étude et ne semblent pas standardisés ;
- –
le faible effectif de patients rend les résultats difficilement interprétables.
Une étude avec un plus grand nombre de patients, comparant l’ISET au diagnostic final obtenu par l’ophtalmologiste de façon standardisée devrait permettre une meilleure évaluation de ce système de triage.
Il s’agit d'une étude préliminaire monocentrique réalisée à l’hôpital ophtalmique Jules Gonin à Lausanne, en trois phases. La première phase consistait à évaluer l’efficacité du système de triage en place et en déduire les améliorations possibles. La deuxième phase consistait en une phase d'élaboration du nouveau système de triage à l’aide de questionnaires remplis par les patients avant la consultation et l’évaluation du degré d'urgence a posteriori à l’aide du diagnostic. La troisième phase permettra de tester l’efficacité du nouveau système de tri élaboré.
Cette étude rétrospective a inclus 1 133 patients consécutifs s’étant présentés aux urgences. Les patients étaient évalués par l’infirmier(ière) d'accueil, qui classait les dossiers en quatre degrés différents d'urgence (ordre de couleur croissant : blanc, jaune, violet, rouge), à l’aide du questionnaire d'évaluation du degré d'urgence (fig. 2-5-13 ), en fonction de la symptomatologie (douleur oculaire, baisse d'acuité visuelle, voile noir, rougeur oculaire, etc.). Les patients étaient ensuite examinés par le médecin, qui, par son examen, évaluait a posteriori le degré d'urgence en fonction du diagnostic. La présence d'un seul symptôme correspondant à une couleur permettait de classer le patient dans cette catégorie de degré d'urgence. Ont également été recueillies les heures d'arrivée du patient, de prise en charge par l’infirmier(ière) d'accueil et par le médecin, afin d'évaluer les temps d'attente. La figure 2-5-14 permet de comparer le tri réalisé par l’infirmier(ière) d'accueil à celui du médecin. On constate qu’il n’existe une adéquation que pour 261 patients (23 %). Il existe une sous-estimation par le tri infirmier chez 15 patients (1,3 % ; fig. 2-5-15 ). Cette faible sous-estimation (faible nombre de faux négatifs) concernait cependant des patients ayant des pathologies graves urgentes, comme un glaucome aigu par fermeture de l’angle chez 2 patients. Dix patients avaient été classés « violets » alors qu’ils auraient dû être classés en « rouge » : 2 glaucomes aigus par fermeture de l’angle, 2 décollements de rétine macula appliquée, 1 névrite optique rétrobulbaire, 1 parésie du IV, 1 parésie du VI, 1 anisocorie et 2 troubles visuels d'allure neurologique. De plus, 76 % des patients étaient surestimés par le triage infirmier (faux positifs ; fig. 2-5-16 ). On constate par ailleurs que la majorité des patients (64 %) étaient triés en « violet » à l’issue du triage infirmier, ce qui montre bien que ce système de tri n’était pas très discriminant (fig. 2-5-17 ). Les résultats de cette étude montraient d'une part une faible adéquation tri infirmier/tri médecin (23 %), avec une forte surestimation du degré d'urgence par le tri infirmier (76 %) et une faible sous-estimation (1 %), mais concernant des cas graves.
La zone encadrée en rouge indique les patients sous-estimés par le tri infirmier.
La zone encadrée en rouge indique les patients sur-estimés par le tri infirmier.
La zone encadrée en violet indique les patients triés « violet » ou « 2 » par l’infirmière et qui représentent la majorité (64 %). La zone encadrée en gris indique les patients triés « blanc » ou « 4 » par le médecin (43 %).
Dans un but d'amélioration du tri infirmier aux urgences ophtalmologiques, une tentative d'élaboration d'un nouveau système a été réalisée. La première phase consistait en l’évaluation de la symptomatologie à l’aide de questionnaires remplis par les patients. La deuxième phase était l’analyse statistique des résultats avec tentative d'élaboration d'un algorithme de tri. Pendant une durée de 2 mois, les patients se présentant aux urgences ont rempli un questionnaire concernant leur symptomatologie, soit sur papier (voir annexe 2-5-2 , Partie 2 – formulaire d'anamnèse d'accueil), soit sur un ordinateur installé dans la salle d'attente (base de données Access ® ; fig. 2-5-18). Ont également été recueillis : l’heure d'arrivée du patient, l’heure de prise en charge par l’infirmier(ière) d'accueil, l’heure de prise en charge par le médecin, le diagnostic retenu. À partir du diagnostic retenu et à l’aide du BAsic SEverity Score for Common OculaR Emergencies ( Base Score ; voir chapitre 1.3 ) [1], la sévérité des items d'urgence a pu être évaluée de façon objective pour l’affection ayant motivé le passage du patient aux urgences ophtalmologiques. Sur 1 732 patients consécutifs recrutés, 1 436 ont été inclus dans l’analyse statistique. La sévérité était cotée de 0 (nulle) à 5. Les résultats montraient que 409 patients avaient une sévérité évaluée à 0 ; 400 patients une sévérité à 1 ; 425 patients une sévérité à 2 ; 145 patients une sévérité à 3 ; 27 patients une sévérité à 4 ; 21 patients une sévérité à 5 (fig. 2-5-19 ).
Une fois les patients triés en salle d'attente, l’ophtalmologiste des urgences recevait les dossiers par ordre de sévérité décroissante. Ainsi, les patients considérés les plus sévères suite au triage étaient vus en priorité. Les patients triés en sévérité 0 ou 1 pouvaient se voir proposer un rendez-vous de consultation rapide dans la semaine, plutôt que de patienter aux urgences et d'obérer la prise en charge d'items plus urgents. Cependant, des études ciblées sur cette problématique sont encore nécessaires avant de proposer une telle organisation.
L’organisation optimale du triage des DSNPO à l’accueil des SU générales ou spécialisées en ophtalmologie améliore la qualité des soins et diminue l’attente. Il n’existe pas de consensus sur un système de triage en ophtalmologie d'urgence actuellement. Avec l’informatisation des hôpitaux et le développement des outils d'aide à la décision, un système informatisé consensuel et fiable de tri des DSNPO serait idéal.
[1] Bourges JL, Boutron I, Monnet D, Brezin AP. Consensus on Severity for Ocular Emergency : The BAsic SEverity Score for Common OculaR Emergencies [BaSe SCOrE]. J Ophthalmol 2015 ; 2015 : 576983.
[2] Farrohknia N, Castren M, Ehrenberg A, et al. Emergency department triage scales and their components : a systematic review of the scientific evidence. Scand J Trauma Resusc Emerg Med 2011 ; 19 : 42.
[3] Jobe J, Ghuysen A, Gerard P, et al. Reliability and validity of a new French-language triage algorithm : the ELISA scale. Emerg Med J 2014 ; 31 : 115‑20.
[4] Taboulet P, Moreira V, Haas L, et al. Triage with the french emergency nurses classification in hospital scale : reliability and validity. Eur J Emerg Med 2009 ; 16(2) : 61‑7.
[5] Banerjee S, Beatty S, Tyagi A, Kirkby GR. The role of ophthalmic triage and the nurse practitioner in an eye-dedicated casualty department. Eye (Lond) 1998 ; 12 : 880‑2.
[6] Nari J, Allen LH, Bursztyn LLCD. Accuracy of referral diagnosis to an emergency eye clinic. Canadian Journal of Ophthalmology 2017 ; 52 : 283‑6.
[7] Buchan JC, Saihan Z, Reynolds AG. Nurse triage, diagnosis and treatment of eye casualty patients : a study of quality and utility. Accid Emerg Nurs 2003 ; 11 : 226‑8.
[8] Buchan JC, Ashiq A, Kitson N, et ak. Nurse specialist treatment of eye emergencies : five year follow up study of quality and effectiveness. Int Emerg Nurs 2009 ; 17 : 149‑54.
[9] Ilango B, McGalliard JN, Hughes A. The role of nurse practitioners in a primary care eye clinic. Accid Emerg Nurs 2000 ; 8 : 42‑5.
[10] Jones NP, Hayward JM, Khaw PT, et al. Function of an ophthalmic « accident and emergency » department : results of a six month survey. Br Med J 1986 ; 292 : 188‑90.
[11] Hau S, Ehrlich D, Binstead K, Verma S. An evaluation of optometrists’ ability to correctly identify and manage patients with ocular disease in the accident and emergency department of an eye hospital. Br J Ophthalmol 2007 ; 91 : 437‑40.
[12] Taleb AC, Bohm GM, Avila M, Wen CL. The efficacy of telemedicine for ophthalmology triage by a general practitioner. J Telemed Telecare 2005 ; 11 : 83‑5.
[13] Fenton S, Jackson E, Fenton M. An audit of the ophthalmic division of the accident and emergency department of the Royal Victoria Eye and Ear Hospital, Dublin. Ir Med J 2001 ; 94 : 265‑6.
[14] Jeannin A, Mortemousque B, Mouriaux F. Prise en charge des urgences ophtalmologiques en structure des urgences : étude multicentrique rétrospective. J Fr Ophtalmol 2016 ; 39 : 589‑95.
[15] Société française de médecine d’urgence. Le triage en structure des urgences. Recommandations formalisées d’experts 2013. En ligne : http://www.sfmu.org/upload/ consensus/RFE_triage_IOA_2013.pdf
[16] Kadyan A, Sandramouli S, Caruana P. Utilization of an ophthalmic casualty--a critical review. Eye (Lond) 2007 ; 21 : 441‑2.
[17] Rossi T, Boccassini B, Cedrone C, et al. Testing the reliability of an eye-dedicated triaging system : the RESCUE. Eur J Ophthalmol 2008 ; 18 : 445‑9.
[18] Rossi T, Boccassini B, Iossa M, et al. Triaging and coding ophthalmic emergency : the Rome Eye Scoring System for Urgency and Emergency (RESCUE) : a pilot study of 1,000 eye-dedicated emergency room patients. Eur J Ophthalmol 2007 ; 17 : 413‑7.
[19] Eijk ES, Busschbach JJ, Monteban H, et al. Towards patient self-triage in the ophthalmic emergency department: sensitivity and specificity of a self-triage instrument. Acta Ophthalmol 2014 ; 92 : 697‑700.
[20] AlSamnan MS, Mousa A, Al-Kuwaileet S, AlSuhaibani AH. Triaging self-referred patients attending ophthalmic emergency room. Saudi Med J 2015 ; 36 : 678‑84.
A. PISON, J.-L. BOURGES
-
Avec l’augmentation croissante du nombre de consultations ophtalmologiques en urgence, la prise en charge d'aval est devenue un point essentiel de l’organisation des SU accueillant l’ophtalmologie.
-
Cinq options d'aval sont possibles en fonction de la pathologie et du contexte : hospitalisation conventionnelle ; hospitalisation ambulatoire ; consultation post-urgence rapide en ophtalmologie ; consultation ophtalmologique dans les délais ; consultation omnipraticienne (médecin généraliste, médecin traitant). Le passage simple sans aval spécifique représente trois quarts des passages en SU.
-
La consultation d'aval fait suite à une consultation d'orientation dans un contexte non programmé. Elle n’est décidée qu’après une consultation non programmée préalable.
-
La consultation d'aval a pour vocation d'être ponctuelle, non renouvelable, centrée sur l’item d'urgence qui la motive. Elle remplace une consultation dont le meilleur délai serait incompatible avec l’impériosité du contrôle nécessaire.
-
La consultation d'aval peut être suivie de contrôles en consultations régulières.
Plusieurs types de structures d'accueil des urgences ophtalmologiques existent en établissement de santé : les centres ophtalmologiques ayant des urgences ophtalmologiques dédiées (SUO), ainsi que les centres hospitaliers et les hôpitaux généraux avec une permanence d'ophtalmologie au sein d'une structure d'urgence générale (SU). La fréquentation grandissante des DSNPO auprès des SU nécessite une organisation d'aval spécifique, adaptée au volume et à la sévérité des items d'urgence des patients [1–3].
La qualité des soins d'urgence est liée à la prise en charge réalisée aux urgences, mais également à leur suivi, c’est-à-dire l’aval de la consultation aux urgences.
Après une consultation non programmée en SU, un contrôle spécialisé est régulièrement nécessaire. Un contrôle post-urgence serait demandé dans un tiers des cas [4–7]. Dans les SUO parisiennes, sur 2 semaines consécutives en 2016, 80 contrôles ont été enregistrés sur les 4 644 passages soit 1,75 %, malgré l’existence d'un aval organisé. Moins l’aval ophtalmologique est organisé, plus ce contrôle devra être réalisé par la SU elle-même. Une carence de contrôle, lorsqu’il est requis, constitue un fonctionnement non conforme. C’est une défaillance médicale et médico-légale (article R. 4127-47 du Code de la santé publique). Ces passages de contrôle en SU contribuent à augmenter l’engorgement de ces structures. Ils allongent leurs délais d'attente (voir plus haut).
L’orientation d'aval dépend essentiellement du diagnostic, mais également du contexte social, de l’expérience du praticien, de la demande du patient, du traitement mis en œuvre, etc. Elle s’organise autour de quatre orientations principales (fig. 2-5-20 ) : l’admission en établissement de soins (hospitalisations complète ou ambulatoire) ; le transfert ; la consultation/soin externe ou l’autosurveillance. Ces options s’envisagent dans les contextes d'aval d'un établissement de soins public ou privé, d'une activité libérale, en hébergement adapté (gériatrie, handicap, carcéral, psychiatrique, etc.), ou à domicile.
ARN : acute retinal necrosis ; ASA : American Society of Anesthesiologists ; CE : corps étranger ; DMLA : dégénérescence maculaire liée à l’âge ; NOIAA : névrite optique ischémique antérieure aiguë ; NORB : névrite optique rétrobulbaire OACR : occlusion de l’artère centrale de la rétine ; OVCR : occlusion de la veine centrale de la rétine ; PEC : prise en charge ; SFAR : Société française d'anesthésie et de réanimation.
L’hospitalisation se justifie pour la réalisation d'un acte invasif ou spécialisé ou une surveillance adaptée. Elle est possible en hospitalisation complète ou ambulatoire. Les chiffres disponibles montrent qu’il ne faut pas sous-estimer la lourdeur éventuelle de prise en charge des urgences ophtalmologiques : entre 1,7 et 3 % des patients nécessitent une hospitalisation aux États-Unis [8–10]. En 2002, une SU hospitalisait en région parisienne entre 2,65 et 4,72 % de ses passages [11]. Stable depuis 2014, la proportion des hospitalisations représente environ 3 % de l’aval de la SUO de l’AP-HP. Elle était de 4,3 % dans les SUO parisiennes en 2016 (recueil de données homogènes sur les passages aux urgences de l’AP-HP – OphtalmoPôle de Paris –, de la fondation ophtalmologique Adolphe de Rothschild et du centre national d'ophtalmologie des Quinze-Vingts sur une période de 15 jours consécutifs), avec une durée moyenne de séjour comprise entre 3 et 3,5 jours (fig. 2-5-21 ). Un tiers des hospitalisations étaient ambulatoires.
Les patients sont principalement hospitalisés dans le cadre d'une intervention chirurgicale, d'un traitement parentéral ou d'instillations horaires ne pouvant être auto-administrées.
Une hospitalisation d'aval ne signifie pas nécessairement que l’item concerné est de mauvais pronostic, ou plus grave qu’un item non hospitalisé. Par exemple, les décollements de rétine (DR) semblaient majoritairement hospitalisés en 2016-2017 sans que leur pronostic ne soit forcément mauvais. Au contraire, on comptabilisait 359 contusions et traumatismes oculaires fermés hospitalisés en France en 2016 [12]. Il s’en est produit malheureusement beaucoup plus, qui étaient potentiellement graves mais ne nécessitant pas d'être hospitalisés.
Les diagnostics entraînant une hospitalisation sont décrits dans les publications de manière hétérogène, tantôt présentés par items, tantôt par classe médico-chirurgicale.
En France, il est possible de consulter la base de données des hospitalisations dans les établissements de santé. Elle est mise en ligne par l’ATIH, organisme public [12]. Il est possible d'en extraire le nombre de séjours annuel liés à quelques items d'urgence en ophtalmologie par groupe homogène de malade (GHM), par diagnostic ou par acte réalisé. Un exemple d'extraction est donné dans le tableau 2-5-3 . On remarque aussi dans cette base de données que la moitié des infections aiguës oculaires hospitalisées étaient d'un niveau de sévérité maximale et que 2,8 % étaient liées aux lentilles de contact en 2016. On note que parmi les affections oculaires d'origine neurologique hospitalisées en 2016, 0,12 % (12/9818) ont conduit au décès du patient.
| Item d'urgence ayant mené à l'hospitalisation | Nombre de séjours | DMS (jours) | |
|---|---|---|---|
| Infection | Endophtalmies | 1 687 | 8,38 |
| Kératites | 5 374 | 5,88 | |
| Conjonctivite aiguë | 309 | 2,2925 | |
| Zona ophtalmique | 544 | 7,83 | |
| Inflammation | Iridocyclites | 1 681 | 4,86 |
| Sclérite/épisclérite | 131 | 3,925 | |
| Kératite intersticielle | 1 682 | 5,68 | |
| Vitréorétine | Décollement de rétine | 25 161 | 1,54 |
| OVCR | 1 572 | 4,69 | |
| OACR | 1119 | 4,42 | |
| Hémorragie du vitré | 2 993 | 1,85 | |
| Hypertonies | CAFA | 1 621 | 2,64 |
| CAFA iatrogènes | 33 | 2,52 | |
| Traumatismes | Plaie du globe | 1 578 | 3,51 |
| Autres traumatismes et contusions | 359 | 2,29 | |
| Cataracte traumatique | 929 | 1,95 | |
| Extraction de CE cornéen | 1 420 | 4,9 | |
| Ulcère de cornée | 648 | 5,42 | |
| Neurologie | Névrite optique | 2 369 | 4,43 |
| Diplopie | 2 253 | 3,26 | |
| Anomalie pupillaire | 159 | 1,52 | |
| Trouble de la vision | 4 490 | 3,48 | |
* Notons que le nombre total de séjour de chaque item ne reflète pas sa prévalence sur l'année, l'hospitalisation n'étant pas le seul aval possible. Les données ont été extraites sur l'année civile 2016 depuis la base Scan Santé de l'ATIH [14].
Les hospitalisations chirurgicales représentaient entre 20 et 34 %% des hospitalisations en région parisienne en 2002 [11] et 56 % dans Paris intramuros en 2016.
Les diagnostics les plus fréquemment hospitalisés en 2002 (avec une expertise du praticien formulant le diagnostic non précisée dans l’étude) étaient : fracture orbitaire (12,7 %), autres pathologies orbitaires (12,4 %), troubles visuels (11,5 %), plaie oculaire transfixiante (8,3 %), autres pathologies liées aux annexes (6,4 %), pathologies rétiniennes (6,2 %). Pour l’année 2016, ces diagnostics sont présentés dans le tableau 2-5-4 .
| Items d'urgence avec hospitalisation d'aval | % |
|---|---|
| Décollement de rétine | 23,4 |
| Neuro-ophtalmologie | 11,2 |
| Suite postopératoire | 11,2 |
| Kératite | 8,6 |
| Traumatisme | 6,5 |
| Endophtalmie | 4,0 |
| Plaie pénétrante | 4,0 |
| Trouble visuel permanent | 3,2 |
| Affection cornéenne (autre que kératite) | 2,5 |
| Diplopie | 2,5 |
| Hypertonie | 2,5 |
| Uvéite antérieure | 2,5 |
| Glaucome aigu par fermeture de l'angle | 2,2 |
| Affection palpébrale | 1,8 |
| Douleur aiguë de la sphère oculo-orbitaire | 1,4 |
| Affection conjonctivale | 1,1 |
| Hémorragie intravitréenne | 1,1 |
| Item lié aux lentilles de contact | 1,1 |
| Items d'oncologie | 1,1 |
* Ne sont reportés que les items représentant plus de 1 % des hospitalisations. Un patient hospitalisé en aval d'un passage en SUO pouvait présenter plusieurs items simultanément. Les pourcentages correspondent au nombre d'items recensés/nombre d'hospitalisations d'aval. Ils ont été estimés à partir d'un échantillon de 4 644 passages en SUO sur 15 jours consécutifs en 2016 à Paris.
Environ 35 % des patients hospitalisés avaient subi un traumatisme en 2002. En 2016 selon le recensement des SUO parisiennes, les traumatismes (plaies pénétrantes + autres traumatismes) ne représentaient plus que 10,5 % des hospitalisations totales. Ils totalisaient 16 % des items d'urgence identifiés dont 2/3 de plaies pénétrantes.
Aux États-Unis, 35 % des patients étaient hospitalisés dans un contexte de traumatisme. Les principaux items ophtalmologiques hospitalisés en aval des urgences étaient la cellulite orbitaire (15,5 %), la fracture orbitaire (12,7 %), les autres pathologies orbitaires (12,4 %), les altérations visuelles (11,5 %), la plaie pénétrante (8,3 %), l’abcès palpébral (6,9 %), les autres pathologies des annexes (6,4 %), ainsi que la pathologie rétinienne (6,2 %) [9, 10].
Le transfert correspond à la réorientation du patient vers une structure de soins ou un établissement plus adaptés. Il a été pratiqué pour 0,6 % (24/4644) des patients des SUO parisiennes en 2016, principalement pour des uvéites antérieures aiguës (44 %) ou des traumatismes orbitaires et faciaux (15 %). Il répond à la nécessité d'une prise en charge sans délai d'un ou de plusieurs items d'urgence, ophtalmologiques ou non, ne pouvant pas être gérés par la SU d'accueil de première ligne. Les modalités du transfert peuvent être protocolisées par des conventions entre établissements de santé, notamment au sein d'un GHT, et formalisées par des projets médicaux partagés (voir plus haut). Ainsi, un transfert en neurochirurgie en raison d'une suspicion d'anévrisme de l’artère communicante postérieure vue en SUO à l’occasion d'une ophtalmoplégie douloureuse, ou encore un transfert en unité stomatologique-maxillofaciale d'une fracture complexe du massif facial examinée en SUO pour une contusion orbitaire sont des exemples typiques.
Un soin externe peut être décidé à la suite d'un passage en SU. Il peut s’agir d'une consultation, d'un acte médical technique ou de petite chirurgie.
La consultation d'aval des urgences est une consultation programmée dans un délai adapté à la surveillance ou à la prise en charge de l’item d'urgence. Ce délai peut donc être plus court qu’un délai normal. La mise à disposition de plages de consultation, d'exploration et de chirurgie externe d'aval d'urgence est donc nécessaire à toute SUO. Cette consultation fait suite à une consultation initiale ou à une consultation d'orientation non programmées et réalisées en SU (voir chapitre 4.1 ). Elle peut s’organiser avec des plages dédiées dans l’établissement de la SU (contrôles immédiats ou surspécialité ophtalmologique en particulier), comme dans le réseau de soins du territoire de santé. En mode sous-optimal, elles sont remplacées par un passage itératif dans la SU. L’idéal pour la SU est de disposer d'un réseau de soins d'aval, avec les partenaires soignants (médecine, orthopties, infirmerie) du territoire de santé, pour suivre le cas échéant l’item d'urgence ophtalmologique à court terme, une fois la prise en charge de première ligne effectuée. Pour les SUO parisiennes en 2016, 18,5 % des patients ayant une DSNPO avaient été orientés vers une consultation d'aval ophtalmologique. La nature des principaux items ayant nécessité ce type d'aval est indiquée dans le tableau 2-5-5 .
| Items d'urgence avec consultation ophtalmologique d'aval | % consultations ophtalmologiques d'aval |
|---|---|
| Altération visuelle permanente | 9,5 |
| Neuro-ophtalmologie | 6,6 |
| Traumatisme non contusif | 6,2 |
| Uvéites | 6,1 |
| Suites postopératoires | 5,3 |
| Conjonctivite | 4,0 |
| Kératite infectieuse | 3,9 |
| Kératite ponctuée superficielle | 3,4 |
| Affection palpébrale | 2,7 |
| Décollement postérieur du vitré | 2,7 |
| Hémorragie intravitréenne | 2,6 |
| Contusion | 2,5 |
| Hypertonie | 2,4 |
| Ulcère cornéen | 2,4 |
| Examen normal | 2,3 |
| Occlusion veineuse rétinienne | 2,2 |
| Néovaisseaux segment postérieur | 2,0 |
| Œdème maculaire | 2,0 |
| Épisclérite/sclérite | 1,9 |
| Affection cornéenne autre | 1,9 |
| Contrôle | 1,9 |
| Déchirure rétinienne | 1,9 |
| Diplopie | 1,7 |
| Affection conjonctivale | 1,5 |
| Douleur aiguë | 1,5 |
| Trouble visuel transitoire | 1,5 |
| Chalazion | 1,4 |
| Trouble réfractif | 1,4 |
| Affection orbitaire | 1,2 |
| Lentille de contact | 1,2 |
| Affection rétinienne autre | 1,1 |
| Voies lacrymales | 1,0 |
* Ne sont reportés que les items représentant plus de 1 % des consultations ophtalmologiques d'aval. Un patient consultant un ophtalmologiste en aval d'un passage en SUO pouvait présenter plusieurs items simultanément. Les pourcentages correspondent au nombre d'items recensés/nombre de consultations ophtalmologiques d'aval. Ils ont été estimés à partir d'un échantillon de 4 644 passages en SUO sur 15 jours consécutifs en 2016 à Paris.
L’aval en consultation non ophtalmologique s’organise autour de deux options :
- –
consultation programmée ou non ;
- –
consultation auprès d'un omnipraticien ou d'un spécialiste.
Il s’agit de consultations filiarisées hors ophtalmologie, adaptées aux items d'urgence. Le patient est orienté vers une consultation de médecine générale, médecine interne, neurochirurgie, stomatologie, ORL, psychiatrie, centre de la douleur, etc. [13]. Cela représentait 4 % de l’aval des DSNPO de notre enquête dans les trois SUO parisiennes. L’avis spécialisé peut aussi être demandé à l’occasion d'un transfert du patient.
À l’issue du passage du patient dans la SU, un bilan exploratoire ou un acte chirurgical externe peuvent être décidés. Une consultation exploratoire est alors réalisée en deux temps, le résultat du bilan devant être obtenu en urgence, avant l’issue du passage. Dans ce cas en revanche, l’acte médical technique ou de petite chirurgie d'aval est programmé dans un second temps, après le passage en SU, dans un délai allant de la semi-urgence au délai normal.
L’autosurveillance est un aval en soi (encadré 2-5-4 ). Un passage en SU et une consultation non programmée ne signifient pas nécessairement que le patient a besoin d'une orientation particulière vers un aval spécifique. La DSNPO peut être gérée dans sa totalité lors du seul passage initial en SU. Dans notre enquête auprès des SUO de Paris en 2016, cela représentait 74,2 % des DSNPO.
Encadré 2-5-4
L’option d'une autosurveillance d'aval implique que :
-
le diagnostic de l’item d'urgence est fiable, certain et stable ;
-
les autres options d'aval ne se justifient pas ;
-
une information adaptée, comprise et tracée est délivrée au patient ;
-
des consignes/instructions d'autosurveillance sont données au patient avec, lorsque cela est possible, la remise d'un formulaire d'autosurveillance adapté. Elles incluent la conduite que le patient doit adopter selon l’évolution observée.
Entre 90 et 97,2 % des patients ont été traités sans être hospitalisés après s’être présentés en SU pour un motif oculaire aux États-Unis [9, 10].
À partir de critères communs de prise en charge externe, en hospitalisation ambulatoire ou en hospitalisation complète, la figure 2-5-20 propose un exemple d'algorithme synthétisant l’aval des items d'urgence en ophtalmologie.
- –
Mise en jeu du pronostic vital ou visuel.
- –
Contexte de prise en charge pluridisciplinaire immédiate, comorbidités déstabilisées ou impactant le pronostic ophtalmologique, score ASA (American Society of Anesthesiologists) défavorable.
- –
Critères psychologiques, sociaux et environnementaux : une surveillance post-urgence est impérative très rapidement, mais on évalue que le patient pourrait ne pas l’honorer (patient vivant seul, âges extrêmes, invalidité, temps d'acheminement trop long, etc.).
Les critères sont ceux de toute chirurgie habituellement réalisée en ambulatoire, à savoir :
- –
modalité administrative : hospitalisation de 12 heures au maximum sans hébergement de nuit ;
- –
critères d'éligibilité des patients à une prise en charge ambulatoire d'après la Société française d'anesthésie réanimation (SFAR) et l’Association française de chirurgie ambulatoire (AFCA) [14] : ils prennent en compte des critères médicaux, chirurgicaux, psychosociaux et environnementaux ainsi que les caractéristiques des suites opératoires possibles (triptyque acte/patient/structure) ;
- –
actes : programmés, de courte durée (1 heure 30 au maximum), à faible risque (hémorragique ou respiratoire), et aux suites opératoires simples (notamment la maîtrise de la douleur et du handicap) ; ils sont élargis à certains items d'urgence simple ou à des interventions plus prolongées, sous réserve d'une durée de surveillance post-anesthésique compatible avec l’horaire de fonctionnement de la structure ;
- –
critères « patients » : compréhension suffisante, bonne observance des prescriptions médicales, conditions d'hygiène et de logement équivalentes à celles d'une hospitalisation, disponibilité d'un accompagnant pour raccompagner le patient et rester la nuit suivante auprès de lui, conditions d'éloignement < 1 heure d'une structure de soins adaptée à l’acte, accès rapide à un téléphone ;
- –
critères médicaux : âge > 6 mois, patients stades ASA 1, 2 ou 3 stabilisés ;
- –
critères d'anesthésie : consultation pré-anesthésique plusieurs jours avant l’acte, fiche d'information, recommandations pré-anes-thésiques, respect des conditions de l’anesthésie, passage en salle de réveil, sortie après autorisation d'un médecin, aptitude à la rue, instructions remises au patient, possibilité de joindre l’anesthésiste ;
- –
critères liés à la structure : information, possibilité d'hospitalisation du patient si besoin.
Mentionnons l’existence d'une circulaire « frontière » (DHOS/F1/MTAA/2006/376 du 31 août 2006) qui précise les actes d'ophtalmologie qui relèvent de consultations externes et non d'une hospitalisation en ambulatoire. Celle-ci exclut, en particulier, d'une prise en charge en hospitalisation ambulatoire les traitements de chalazion, les traitements ophtalmologiques utilisant un laser et réalisés sans anesthésie, ainsi que les actes de petite chirurgie réalisés sous anesthésie locale.
Les critères communs d'une prise en charge externe sont la présence d'un item d'urgence sans facteur de gravité, ne mettant pas en jeu le pronostic vital ou visuel, et pouvant justifier d'une autosurveillance. La figure 2-5-20 détaille ces critères de prise en charge externe après passage en SU. Cinq situations sont à distinguer :
- –
contrôle ophtalmologique dans le réseau des urgences ou « consultation d'aval d'urgence » : item d'urgence ophtalmologique sans facteur de gravité majeur, mais nécessitant une surveillance rapprochée (par exemple, décollement postérieur du vitré, hémorragie du vitré, urgences maculaires, etc.) ;
- –
contrôle ophtalmologique dans les délais classiques : item d'urgence ophtalmologique sans facteur de gravité ni surveillance rapprochée nécessaire (par exemple, trouble réfractif, cataracte, ptérygion, etc.) ;
- –
nécessité d'un contrôle auprès du médecin traitant : item d'urgence ophtalmologique nécessitant un avis médical général ou spécialisé pour une prise en charge pluridisciplinaire (par exemple, hémorragie sous-conjonctivale, migraine ophtalmique, etc.) ;
- –
contrôle non ophtalmologique auprès d'une filière de soins appropriée ;
- –
programmation d'un bilan exploratoire ou d'un acte de petite chirurgie non éligible à l’hospitalisation.
L’accueil d'une DSNPO a pour objet d'identifier un item d'urgence d'ophtalmologie et de le prendre en charge. L’accueil, l’examen, l’exploration et les soins initiaux permettent sa gestion totale dans environ trois quarts des cas. Dans les autres situations, il est nécessaire de proposer un suivi, une surveillance ou une prise en charge élaborée. Cela constitue l’aval des urgences ophtalmologiques. Il s’organise vers une consultation externe, une hospitalisation ou un transfert vers une structure de soins plus adaptée. Il peut nécessiter une simple autosurveillance. Dans le contexte d'une offre de soins ophtalmologiques à délais normaux souvent longs, l’aval d'une prise en charge d'urgence doit être organisé en permanence et en amont, avec le réseau territorial de santé.
[1] NHS Digital. Focus on accident and emergency. 2013. En ligne : http://content.digital. nhs.uk/catalogue/PUB13040/acci-emer-focu-on-2013-rep-V2.pdf
[2] MacEwen C, Buchan J. The way forward : options to help meet demand for the current and future care of patients with eye disease. En ligne : https://www.rcophth.ac.uk/ wp-content/uploads/2015/10/RCOphth-The-Way-Forward-Glaucoma-300117.pdf
[3] Resnikoff S, Felch W, Gauthier TM, Spivey B. The number of ophthalmologists in practice and training worldwide : a growing gap despite more than 200,000 practitioners. Br J Ophthalmol 2012 ; 96 : 783‑7.
[4] Bhopal R, Parkin D, Gillie R, Han K. Pattern of ophthalmological accidents and emergencies presenting to hospitals. J Epidemiol Community Health 1993 ; 47 : 382‑7.
[5] Fenton S, Jackson E, Fenton M. An audit of the ophthalmic division of the accident and emergency department of the Royal Victoria Eye and Ear Hospital, Dublin. Irish Medical Journal 2001 ; 94 : 265‑6.
[6] Hau S, Ioannidis A, Masaoutis P, Verma S. Patterns of ophthalmological complaints presenting to a dedicated ophthalmic Accident & Emergency department : inappropriate use and patients’ perspective. Emergency Medicine Journal 2008 ; 25 : 740‑4.
[7] Sánchez Tocino H, Galindo Ferreiro A, Iglesias Cortiñas D, et al. Estudio epidemiológico de las urgencias oftalmológicas en un hospital general. Archivos de la Sociedad Española de Oftalmología 2004 ; 79 : 425‑32.
[8] Nash EA, Margo CE. Patterns of emergency department visits for disorders of the eye and ocular adnexa. Arch Ophthalmol 1998 ; 116 : 1222‑6.
[9] Vaziri K, Schwartz SG, Flynn HW, Jr., et al. Eye-related Emergency Department Visits in the United States, 2010. Ophthalmology 2016 ; 123 : 917‑9.
[10] Channa R, Zafar SN, Canner JK, et al. Epidemiology of Eye-Related Emergency Department Visits. JAMA Ophthalmol 2016 ; 134 : 312‑9.
[11] Girard B, Bourcier F, Agdabede I, Laroche L. Activité et épidémiologie d’un centre d’urgence en ophtalmologie. J Fr Ophtalmol 2002 ; 25 : 701‑11.
[12] ScanSanté [Internet]. agence technique de l’information sur hospitalisation (ATIH). 2017 [cited 12/08/2017]. Available from: http://www.scansante.fr/applications/statistiquesactivite- MCO-par-diagnostique-et-actes.
[13] Rigal-Sastourné JC. Rapport d’expertise PSDES nuit profonde en ophtalmologie. 2012. En ligne : http://www.sante-iledefrance.fr/PDSES/RAPPORT_OPHTALMO_PDSES.pdf
[14] SFAR. Recommandations formalisées d’experts : prise en charge anesthésique des patients en hospitalisation ambulatoire. Annales Françaises d’Anesthésie et de Réanimation 2010..
A. PISON, J.-L. BOURGES
-
Les protocoles ont pour but de partager des informations entre les acteurs de santé, proposer des critères de soins standardisés et homogénéiser les pratiques.
-
L’élaboration et la validation d'un protocole répondent à une démarche qualité institutionnelle en établissement de santé et en cabinet.
Les grands types de protocoles traités dans ce sous-chapitre sont diagnostiques, d'orientation initiale et thérapeutiques. D’autres types de protocoles existent.
Un protocole de soins correspond à l’ensemble des règles à respecter pour la réalisation et la mise en place d'une stratégie diagnostique et thérapeutique. Il peut être destiné à : homogénéiser des pratiques professionnelles, organiser des pratiques pluriprofessionnelles, mieux gérer une situation de soins (par exemple, accueil, triage, examen, exploration, délégation de tache, prise en charge), vérifier une liste de sécurité, servir de rappel et aide-mémoire, participer à l’enseignement et à la formation continue. Sa réalisation est généralement consensuelle, élaborée avec les branches professionnelles concernées. Un guide d'élaboration des protocoles a été conçu par la Haute Autorité de santé ou HAS (encadré 2-5-5 ). Une méthode et des exemples sont disponibles en ligne [1].
Encadré 2-5-5
Dans son travail, le collège de la HAS précise que les protocoles de santé :
-
décrivent qui fait quoi, quand, comment, pourquoi, pour qui et avec qui ;
-
s’appuient sur l’expérience et les compétences des professionnels concernés ;
-
prennent en compte les données actualisées de la littérature ;
-
formalisent et harmonisent des pratiques existantes ;
-
proposent des voies de progrès, par de nouveaux services ou de nouveaux rôles ;
-
renforcent et sécurisent les soignants ;
-
sont aisément consultables lors des soins ;
-
conçoivent le soin et le « prendre soin » comme un seul soin,
-
peuvent s’accompagner de valorisations financières et de ressources adaptées à leur usage ;
-
sont régulièrement actualisés à la lumière de retours d'expériences,
-
s’inscrivent dans la démarche qualité des équipes de soins.
On perçoit l’intérêt évident d'établir et d'utiliser des protocoles dans le cadre de la prise en charge des demandes de soins non programmés en ophtalmologie (DSNPO). En particulier, ils trouvent leur utilité en cabinet de ville pour l’orientation des DSNPO, depuis l’accueil téléphonique jusqu’à l’adressage éventuel, et la gestion du parcours de soins de tel ou tel item d'urgence. En structure d'urgence, ils aident à homogénéiser les pratiques d'équipes nombreuses, changeantes et pluridisciplinaires. Ils s’imposent au niveau du triage des DSNPO, notamment en structure d'urgence générale. Là, comme c’est fréquemment le cas en France pendant la période de permanence des soins des établissements de santé (PDSES), la DSNPO n’est en règle pas prise en charge en première ligne de manière spécialisée [2]. Les protocoles sont exploités aussi au niveau des parcours de soins (annexe 2-5-4 ). Les protocoles thérapeutiques permettent d'optimiser les interactions pluriprofessionnelles, notamment en les sécurisant et en les accélérant dans le cadre de l’urgence.
Annexe 2-5-4
-
Origine : service d'ophtalmologie du Pr P.-J. Pisella, centre hospitalier universitaire Bretonneau, Tours.
-
Type de protocole : protocole diagnostique et d'orientation.
-
Acteur(s) concerné(s) : médecin des urgences générales.
- 1.Remise au patient de la fiche d'information éditée par le centre hospitalier universitaire de Tours.
- 2.Information sur la durée de validité (3 ans) de la prescription de verres correcteurs.
- 3.Consultation avec l’ophtalmologiste libéral.
-
Rougeur oculaire en nappe sectorielle ou diffuse.
-
Favorisée par la prise d'antiagrégant plaquettaire (Kardégic ® , Plavix ® ) ou d'anticoagulant (Préviscan ® , Coumadine ® ).
-
Signes négatifs indispensables : absence de notion de traumatisme ; absence de douleurs ; absence de baisse de vision.
- 1.Hydratation.
- 2.Information sur la possibilité d'extension et de modification de teinte du saignement.
- 3.Consultation auprès du médecin traitant pour contrôle tensionnel.
-
Kératite aiguë bilatérale secondaire à un traumatisme par des ultraviolets par soudure à l’arc.
-
Œil rouge, douloureux avec baisse d'acuité visuelle inconstante.
- 1.Anesthésique local : oxybuprocaïne 1 goutte dans chaque œil.
- 2.Si patient accompagné ou ne rentrant pas en voiture :
- ▪Tobrex ® pommade 1 application dans chaque œil ;
- ▪pansement occlusif sur l’œil le plus douloureux.
- 3.Paracétamol 1 g en l’absence d'allergie.
- 4.Consultation le lendemain à 8 heures 30 aux urgences ophtalmologiques.
-
Importance du mécanisme lésionnel à faible cinétique (meulage le plus souvent).
-
Signe négatif indispensable : absence de baisse d'acuité visuelle.
- 1.Anesthésique local : oxybuprocaïne 1 goutte.
- 2.Si patient accompagné ou ne rentrant pas en voiture :
- ▪Tobrex ® pommade ;
- ▪pansement occlusif sur l’œil.
- 3.Paracétamol 1 g per os en l’absence d'allergie.
- 4.Consultation le lendemain matin à 8 heures 30 aux urgences ophtalmologiques.
-
Atteinte uni- ou bilatérale.
-
Œil pouvant présenter les associations suivantes : rouge, larmoyant, collé avec des sécrétions purulentes.
-
Sensation de brûlures, picotements, démangeaisons.
-
Signes négatifs indispensables : absence de baisse de vision ; absence de douleur.
- 1.Lavage au sérum physiologique.
- 2.Instillation de Tobrex ® collyre.
- 3.Hygiène des mains (frictions hydro-alcooliques ; lavage au savon).
- 4.Ne pas se frotter les yeux.
- 5.Consultation le lendemain à 8 heures 30 aux urgences ophtalmologiques ou consultation auprès du médecin traitant.
-
Lésion inflammatoire (rouge, douloureuse, gonflée) de la paupière supérieure ou inférieure d'apparition brutale.
-
Pouvant être fistulisée à la peau et suppurer.
-
Signes négatifs indispensables : absence de rougeur oculaire ; absence de baisse de vision.
- 1.Instillation de Tobrex ® pommade.
- 2.Massages à l’aide de compresses d'eau chaude 3 fois/jour pendant 15 jours.
- 3.Consultation le lendemain à 8 heures 30 aux urgences ophtalmologiques ou consultation auprès du médecin traitant.
-
Myodésopsies : perception de mouches volantes, de filaments, de toiles d'araignée liée au décollement du vitré.
-
Phosphènes : perception de flashs lumineux, d'éclairs, de scintillements liée à la traction du vitré sur la rétine.
-
Signes négatifs indispensables : absence de baisse de vision ; absence d'amputation du champ visuel ; âge < 40 ans.
- 1.Hydratation.
- 2.Consultation le lendemain à 8 heures 30 aux urgences ophtalmologiques.
- 3.Informer le patient sur la nécessité d'être accompagné pour la réalisation du fond d'œil.
Actuellement en France, les protocoles organisationnels sont élaborés à l’échelle locale et ne sont pas opposables. En revanche, les protocoles de soins infirmiers sont apparentés à une prescription, donc pouvant être prescrits, et dans ce cas opposables. Ils s’appuient en cela sur le décret n° 2004-802 du 29 juillet 2004 relatif aux actes professionnels et à l’exercice de la profession d'infirmier.
Dans ce sous-chapitre, nous fournissons l’exemple de protocoles utilisés dans différents centres médicaux français, à titre d'information.
La mise en place de protocoles s’inscrit dans une démarche de qualité des soins. Pour une situation et/ou un besoin explicites, il s’agit de formaliser :
- –
la définition d'une procédure opérationnelle. La procédure est décrite de manière linéaire simple. L’enchaînement de ses étapes constitue le processus opérationnel. Il peut être illustré par un logigramme. Elle mentionne les différents acteurs impliqués, selon une réponse graduée en rapport avec l’urgence ;
- –
le protocole de soins d'urgence infirmier qui en découle ;
- –
une procédure d'évaluation a posteriori.
La rédaction des protocoles doit faire l’objet d'un consensus entre l’équipe médicale et paramédicale, avec l’aide des cadres de santé (encadré 2-5-6 ).
Encadré 2-5-6
-
Déterminer la situation pour laquelle un protocole répond à un besoin.
-
Informer les professionnels concernés.
-
Former un groupe de travail de plusieurs professionnels.
-
Analyser la pratique courante, vérifier les domaines de compétence des acteurs.
-
Définir les objectifs et les bonnes pratiques collectés dans la littérature.
-
Écrire un protocole simple et bref, en précisant les étapes et leur enchaînement, les périmètres d'action des différents professionnels.
-
Associer les guides de fonctionnement au protocole : par exemple, champ d'application, logigrammes, points de vigilance, harmonisation de l’information.
-
Diffuser et rendre accessible à qui de droit (professionnels, patients, système d'information).
-
Recueillir les évolutions souhaitables, les dysfonctions du protocole, les variations d'utilisation liées à la pratique de terrain.
-
Mettre à jour le protocole à chaque fois que c’est utile.
-
Protocoliser n’importe quoi, de manière inadaptée ou disproportionnée.
-
Consommer abusivement les ressources nécessaires ailleurs pour l’élaboration de protocole.
-
Maintenir un protocole non utilisé, mal adapté ou mal accepté.
Nous donnons ici quelques exemples non exhaustifs de protocoles diagnostiques, de soins courants, de chemin clinique et thérapeutiques. Chaque protocole s’applique à l’environnement pour lequel il a été conçu et validé. Les protocoles ci-dessous sont forcément imparfaits, et font l’objet d'évolutions guidées par le retour d'expérience. Ils n’excluent absolument pas l’élaboration de documents différents protocolisant un champ d'application similaire mais dans une structure ou un environnement différents. Ils sont fournis au lecteur afin de servir de base de réflexion et au besoin de travail aux équipes de soins pluriprofessionnelles. Des exemples de protocoles et formulaires de triage des urgences figurent aussi dans les annexes du chapitre 2.5.3 .
- –
Origine : protocole en vigueur à l’OphtalmoPôle de Paris.
- –
Type de protocole : protocole de soins courants.
- –
Acteur(s) concerné(s) : infirmier(ière), médecin.
- –
Standardiser les pratiques professionnelles, déterminer les règles d'administration du collyre. Mettre en œuvre la délégation de tache entre médecin et infirmier(e) dans le domaine de l’administration topique de principes actifs oculaires.
- –
Titre : instillation d'un traitement médicamenteux sous forme de collyre pour les patients, à visée diagnostique, thérapeutique et/ou analgésique.
- –
Services d'ophtalmologie.
- –
Personnel médical, paramédical (IDE/IBODE/IADE).
- –
Instillation : action d'introduire un liquide médicamenteux, goutte par goutte, dans une cavité naturelle de l’organisme.
- –
Collyre : médicament liquide qui s’applique sur la conjonctive de l’œil.
- –
Topique : mode d'administration désignant l’endroit où le médicament est appliqué (par exemple, sur la peau ou une muqueuse).
- –
Décret n° 2004-802 du 29 juillet 2004 du Code de la santé publique (CSP) relatif à l’exercice de la profession d'infirmier(ière).
- –
Information et consentement du patient.
- –
Article R. 5132-3 du CSP modifié par décret n° 2007-536 du 24/04/2007 – art. 1. Journal Officiel n° 256, avril 2007.
- –
Dossier médical (prescription).
- –
Procédures du service : « Vérification de l’identité du patient au cours de sa prise en charge », « Administration du médicament, sécurisation du circuit du médicament ».
- –
Indications :
- •
à visée diagnostique : examens (par exemple fond d'œil) ;
- •
à visée thérapeutique : chirurgicale (pré-, per- et postopératoire ; par exemple dilatation) ; traitement (par exemple glaucome, abcès de cornée, etc.) ; après un acte invasif aux urgences (par exemple ablation de corps étranger) ;
- •
à visée analgésique : acte chirurgical (anesthésie topique) ; examen nécessitant une anesthésie locale ; en cas de douleur.
- •
- –
Contre-indications : intolérance, allergie à la molécule prescrite.
- –
Contre-indication relative :
- •
liée à la pathologie ;
- •
interaction médicamenteuse.
- •
- –
Vérification de la prescription et de la latéralité d'instillation.
- –
Absence de contre-indication.
- –
Consentement du patient.
- –
Information du patient sur les effets attendus de l’instillation (par exemple dilatation pupillaire si mydriatique).
- –
Picotements.
- –
Sensation de gêne (brûlure et/ou irritation).
- –
Trouble de la vision.
- –
Larmoiement.
- –
Solution ou gel hydro-alcoolique.
- –
Compresses, pansement ophtalmique, sparadrap si besoin.
- –
Collyre.
- –
Réceptable à déchets.
- –
Gants si besoin.
- –
À l’aide du dossier médical, vérification de la prescription, de la latéralité.
- –
Prévenir le patient.
- –
Vérification de l’identité du patient.
- –
Lavage des mains.
- –
Préparation du matériel.
- –
Expliquer le déroulement du soin.
- –
Installer le patient assis ou allongé selon son état général.
- –
Se placer face à lui et/ou du côté de l’œil à instiller.
- –
Se laver les mains (friction gel hydro-alcoolique).
- –
Baisser la paupière inférieure à l’aide d'une compresse.
- –
Instiller une goutte de collyre (unidose) dans le cul-de-sac conjonctival.
- –
Demander au patient de fermer l’œil.
- –
Évacuer le superflu à l’aide d'une compresse.
- –
Attendre quelques minutes entre chaque instillation si plusieurs collyres.
- –
Se laver les mains.
- –
Tracer par écrit l’instillation.
- –
S’assurer de l’absence d'effets secondaires ou d'intolérance liée au traitement.
- –
Vérifier l’efficacité (par exemple dilatation, diminution de la douleur, etc.).
- –
Alerter, tracer les effets indésirables.
- –
Origine : protocole en vigueur à l’OphtalmoPôle de Paris.
- –
Type de protocole : protocole de soins courants.
- –
Acteur(s) concerné(s) : infirmier(ière), médecin.
- –
Éduquer le patient à l’administration du traitement médicamenteux d'antibiothérapie sous forme de collyre, à visée diagnostique, thérapeutique.
- –
Respecter la prescription des collyres renforcés : multithérapie utilisée afin d'émettre une synergie d'action et un élargissement du spectre antibactérien, et de limiter l’apparition d'une résistance.
- –
Service d'ophtalmologie.
- –
Tout patient pris en charge dans le cadre d'une hospitalisation conventionnelle.
- –
Personnel médical et paramédical.
- –
Patient et famille.
- –
Instillation : méthode thérapeutique consistant à introduire, goutte à goutte, une solution médicamenteuse dans un conduit naturel pour laver, désinfecter et traiter ce conduit.
- –
Collyre : solution stérile instillée en gouttes dans le cul-de-sac conjonctival inférieur pour produire un effet sur l’œil.
- –
Multithérapie : traitement qui emploie simultanément plusieurs principes actifs pour traiter.
Exemple d'association de collyres antibiotiques : (P) pipéracilline 2 %, 20 mg/ml : antibiotique de la famille des ureidopénicillines ;
(A) amikacine 3,00 %%, 30 mg/ml : antibiotique de la famille des aminosides ;
(V) vancomycine 5,00 %, 50 mg/ml : antibiotique de la famille des glycopeptides.
- –
Décret n° 2004-802 du 29 juillet 2004 du CSP relatif à l’exercice de la profession d'infimier(ière).
- –
Article R. 5132-3 du CSP modifié par décret n° 2007-536 du 24/04/2007 – art.1 : information et consentement du patient.
- –
Article R. 4311-5 du CSP : « 28° Irrigation de l’œil et instillation de collyres ».
- –
Article L. 1161 du CSP : « L’éducation thérapeutique du patient s’inscrit dans le parcours du soin du patient. Elle a pour objectif de rendre le patient plus autonome en facilitant son adhésion au traitement prescrit. »
- –
Dossiers de soins infirmiers et médical.
- –
Livret de suivi d'éducation thérapeutique.
- –
Solution hydro-alcoolique.
- –
Compresses.
- –
Flacons de collyres.
- –
Gants.
- –
Réceptacle à déchets.
- –
Indications : sur prescription médicale pour les kératites bactériennes graves.
- –
Contre-indications : allergies, hypersensibilité à l’un des collyres.
- –
Contre-indication relative : liée aux pathologies (par exemple aggravation sous traitement).
- –
Le port de lentilles de contact est proscrit pendant la durée du traitement.
- –
S’enquérir de la posologie diurne et nocturne.
- –
Ne pas prolonger le traitement au-delà de la date prévue par le médecin et respecter strictement la prescription.
- –
Prévenir le médecin en cas d'apparition d'irritation persistante et prolongée au cours du traitement.
- –
Avant ouverture : ces collyres doivent être conservés au réfrigérateur entre + 2 et + 8 °C et à l’abri de la lumière jusqu’à 1 mois.
- –
Après ouverture : ils doivent être conservés dans les mêmes conditions, mais leur durée de conservation est de 15 jours (ne pas dépasser la date limite d'utilisation).
- –
Avant ouverture : ce collyre doit être conservé à une température inférieure à + 25 °C et à l’abri de la lumière jusqu’à 1 mois.
- –
Après ouverture : il doit être conservé dans les mêmes conditions, mais sa durée de conservation est de 15 jours (ne pas dépasser la date limite d'utilisation).
- –
Un intervalle de 5 minutes entre chaque instillation de collyre est nécessaire (une instillation effectuée sans intervalle annule l’effet de chaque collyre).
- –
S’assurer de l’absence d'intolérance liée au traitement.
- –
Vérifier l’efficacité (diminution de la douleur).
- –
Alerter, tracer les effets indésirables.
- –
Picotements.
- –
Sensation de gêne (brûlure et/ou irritation).
Dossiers de soins infirmiers et médical (vérification de la prescription).
- –
Avant le soin : dossiers de soins infirmier et médical (vérification de la prescription).
- –
Pendant l’administration, démarche éducative à l’instillation des collyres renforcés :
- •
« l’éducation thérapeutique du patient s’inscrit dans le parcours de soins du patient. Elle a pour objectif de rendre le patient plus autonome en facilitant son adhésion au traitement prescrit » (article L. 1161 du CSP) ;
- •
le traitement par collyres renforcés est très contraignant pour le patient et peut nuire à l’observance thérapeutique du fait de l’instillation de collyres distincts et de leur fréquence d'administration ;
- •
la démarche éducative par le professionnel de soins améliore et optimise l’observance du traitement ;
- •
informer le patient sur son état de santé en rapport avec son traitement pour obtenir son adhésion au schéma thérapeutique.
- •
- –
Questionner le patient sur ses attentes.
- –
Observer sa réceptivité à la proposition d'une éducation.
- –
Évaluer ses potentialités.
- –
Appréhender sa manière de réagir à sa situation.
- –
Identifier les ressources sociales : s’assurer que le patient est autonome pour l’instillation des collyres lors du retour à domicile ou proposer des solutions adaptées à l’observance du traitement.
- –
Informer sur la thérapie, son indication et la technique d'administration du traitement de manière orale et/ou écrite et à l’aide de supports (notice d'emploi, mise en place d'une planification horaire sous forme d'un tableau ou d'un cahier).
- –
Définir les consignes de sécurité : mode de conservation des collyres, date de péremption.
- –
Respecter les règles d'hygiène avant et après instillation des collyres.
- –
Informer sur les précautions d'emploi et les effets indésirables éventuels.
- –
Démonstration de l’instillation des collyres par le professionnel en expliquant le soin au patient ou aux accompagnants (par exemple conjoint, personne de confiance, auxiliaire de vie).
- –
Préparer et installer le matériel.
- –
Se laver les mains ou friction avec une solution hydro-alcoolique.
- –
Installer le patient.
- –
Se placer face au patient.
- –
Demander au patient d'incliner la tête en arrière et de regarder vers le haut.
- –
Poser une compresse en bas de la paupière inférieure (afin de retirer l’excédent de collyre).
- –
En cas de sécrétions, nettoyer l’œil : de l’angle interne vers l’angle externe de l’œil, à l’aide d'une compresse non tissée, non stérile imbibée de sérum physiologique.
- –
Abaisser la paupière inférieure à l’aide de la compresse posée préalablement.
- –
Tirer délicatement à l’aide de la compresse la paupière inférieure vers le bas.
- –
Instiller le nombre de gouttes prescrit, flacon positionné vers le bas, maintenu par le pouce et l’index, en évitant que l’embout du flacon ne touche l’œil.
- –
Attendre 5 min entre chaque instillation de goutte.
- –
Faire faire par le patient ou la personne référente plusieurs fois en présence du professionnel.
- –
Laisser faire le patient ou la personne référente sans la présence du professionnel.
- –
Contrôler et reformuler si nécessaire avec le patient :
- •
ce qu’il sait concernant l’indication des collyres ;
- •
ce qu’il a compris : l’importance de l’intervalle de 5 minutes entre chaque instillation ;
- •
ce qu’il sait faire et appliquer (administration des collyres).
- •
- –
Partager les informations avec les autres professionnels de santé (IDE) impliqués dans la prise en charge du patient.
- –
Dans le cas d'une démarche éducative échéante, proposer une nouvelle offre (éléments à acquérir, à mobiliser ou à retenir), en tenant compte des données de cette évaluation.
- –
Surveillance après administration :
- •
s’assurer de l’absence d'intolérance liée au traitement ;
- •
vérifier l’efficacité : utilisation de la planification et de la traçabilité, évaluation de la douleur ;
- •
alerter, tracer les effets indésirables ;
- •
effectuer le suivi du malade : dossier de sortie du patient ;
- •
s’assurer que le patient a :
- –
sa prochaine date de rendez-vous à J8 après sa sortie ;
- –
les informations nécessaires et les numéros d'appel du service et des urgences ophtalmologiques en cas de besoin.
- –
- •
Réduire la durée d'hospitalisation.
- –
Origine : protocole en vigueur à l’OphtalmoPôle de Paris.
- –
Type de protocole : protocole de soins courants.
- –
Acteur(s) concerné(s) : infirmier(ière), médecin.
Traitement médicamenteux par voie veineuse sur prescription médicale, indiqué par exemple pour les rejets de greffes, les œdèmes de cornée, les uvéites, les syndromes inflammatoires, etc.
- –
Services d'ophtalmologie.
- –
Tout patient pris en charge.
- –
Personnel médical et paramédical (IDE, IBODE).
- –
Décret n° 2004-802 du 29 juillet 2004 du CSP relatif à l’exercice de la profession d'infirmier(ière).
- –
Information et consentement du patient.
- –
Article R. 5132-3 du CSP modifié par décret n° 2007-536 du 24/04/2007 – art. 1. Journal Officiel n° 256, avril 2007.
- –
Méthylprednisolone (Solumédrol ® ) : anti-inflammatoire stéroïdien, corticoïde à action immédiate.
- –
Ionogramme : il effectue le dosage des principaux constituants ioniques du sang. Ce dosage sert à :
- •
dépister un déséquilibre hydro-électrolytique pouvant entraîner des conséquences sur le métabolisme. La surveillance de l’équilibre potassique est particulièrement importante ;
- •
surveiller les apports hydriques par perfusion.
- •
- –
Urée : le taux d'urée dépend de la fonction rénale, des apports alimentaires en protéines, de l’état d'hydratation. L’augmentation de son taux dans le sang est généralement liée à une altération rénale.
- –
Créatinine : la concentration de la créatinine dans le sang dépend de la capacité d'élimination du rein et de la masse musculaire. Son évaluation permet d'apprécier un dysfonctionnement de la filtration rénale.
- –
Électrocardiogramme (ECG) : il correspond à l’enregistrement de l’activité électrique du cœur, nécessaire à ses contractions.
- –
Antiseptie de la peau saine avant tout geste invasif.
- –
Guide des antiseptiques et désinfectants disponibles et leurs indications.
- –
Prévention des infections liées aux cathéters veineux périphériques. Recommandations pour la pratique clinique.
- –
Bon usage des dispositifs médicamenteux de perfusion.
- –
Recommandations : surveiller et prévenir les infections associées aux soins.
- –
Dossier médical (prescription).
- –
Procédures du service concernant « Vérification de l’identité du patient au cours de sa prise en charge », « Administration du médicament, sécurisation du circuit du médicament » et « Cathéters veineux périphériques ».
- –
Indications : sur prescription médicale pour les rejets de greffes, œdèmes de cornée, uvéites, syndromes inflammatoires, etc.
- –
Contre-indications : intolérance, allergie à la molécule prescrite.
- –
Contre-indication relative :
- •
liée aux pathologies ;
- •
interaction médicamenteuse.
- •
- –
Examens obligatoires avant la pose :
- •
ionogramme sanguin à J1 ;
- •
urée, créatinine à J1 et J3 ;
- •
ECG.
- •
- –
Régimes hyposodé strict et hypoglucidique.
- –
Pour les patients diabétiques et/ou présentant une pathologie cardiaque : faire l’ionogramme et l’ECG tous les jours avant la perfusion.
- –
Contrôle de la glycémie capillaire (hémoglucotest ou HGT) 1 fois/équipe.
- –
Perfusion à passer de préférence le matin.
- –
Rétention d'eau.
- –
Hyperexcitabilité, troubles de l’humeur, insomnie.
- –
Perturbation de la natrémie et de la kaliémie.
- –
Déséquilibre des pathologies rénales, diabétiques, cardiaques.
- –
Dossier médical.
- –
Vérifier l’intégralité du conditionnement, de la date de péremption des matériels et produits.
- –
Réceptacle à déchets.
- –
Gants si besoin.
- –
Solution ou gel hydro-alcoolique.
- –
Flacon de méthylprednisolone et solvant.
- –
Matériel nécessaire à l’administration médicamenteuse par voie veineuse : antiseptique cutané, compresses, garrot, cathlon, prolongateur avec robinet 3 voies, obturateur, seringues, aiguilles, ampoule de chlorure de sodium, eau pour préparation injectable, tubulure à perfusion, soluté de glucosé 5 %, pansements Opsite ® , protection à mettre sous le site d'insertion du cathlon si pose de celui-ci.
- –
Montrer les résultats sanguins et le tracé ECG pour valider la perfusion.
- –
À l’aide du dossier médical, vérifier la prescription.
- –
Vérifier l’identité du patient.
- –
Prévenir le patient.
- –
Se laver les mains.
- –
Surveiller les paramètres hémodynamiques (tension artérielle ou TA et pulsations) et l’HGT.
- –
Préparer le matériel nécessaire à la pose de la perfusion et s’assurer de la présence d'un pied à perfusion dans la chambre du patient.
- –
Diluer la suspension médicamenteuse au regard de la prescription.
- –
Respecter les précautions standard tout au long du soin.
- –
Expliquer le déroulement du soin.
- –
Se laver les mains (procédure hygiène des mains).
- –
Si cathéter veineux en place, vérifier la perméabilité de la veine et la fonctionnalité du cathéter à l’aide d'une seringue de sérum physiologique.
- –
Brancher la perfusion.
- –
Mettre la perfusion en route en fonction du débit calculé. Recommandation des bonnes pratiques de la perfusion.
- –
Si pose d'un cathéter veineux, se reporter à la procédure cathéters veineux périphériques (pose, maintenance, pansement, ablation).
- –
Surveiller la tension artérielle au démarrage et 30 min après le début de la perfusion.
- –
Surveillance des paramètres TA, pouls et HGT.
- –
Contrôle des manifestations liées aux effets secondaires.
- –
Traçabilité des soins dans le dossier infirmier.
- –
Origine : OphtalmoPôle de Paris.
- –
Type de protocole : protocole thérapeutique de soins courants.
- –
Acteur(s) concerné(s) : infirmier(ière), médecin.
- –
Glaucome aigu, hypertonie du globe oculaire.
- –
Sur prescription médicale écrite, datée et signée.
- –
Absolue : hypertension artérielle, insuffisance cardiaque, déshydratation (à prédominance intracellulaire).
- –
Relative : certaines cardiopathies, insuffisance rénale.
- –
Avant toute utilisation : ionogramme sanguin et électrocardiogramme à montrer à un médecin avant de débuter la perfusion.
- –
Vérification du flacon : date de péremption, dosage.
- –
Dose habituelle : 250 ml/j à raison de 40 gouttes/min en perfusion avec tubulure à filtre.
- –
Prescription de potassium en fonction du ionogramme sanguin.
Surveillance : pouls, pression artérielle toutes les 5 minutes durant la perfusion, température au début et à la fin de la perfusion, contrôle ionogramme sanguin dès le lendemain.
- –
Origine : protocole élaboré à l’hôpital de la Croix-Rousse, service du Pr L. Kodjikian, Lyon.
- –
Type de protocole : protocole diagnostique, protocole de chemin clinique, protocole thérapeutique.
- –
Acteur(s) concerné(s) : personnel d'accueil, infirmier(ière), médecin, pharmacien hospitalier.
Tout œil rouge et/ou douloureux et/ou sujet à une anomalie de vision, dans la période postopératoire, est à considérer comme une endophtalmie jusqu’à preuve du contraire.
- –
Endophtalmie : processus inflammatoire d'origine infectieuse, atteignant les couches internes pariétales endosclérales et les cavités oculaires (chambres antérieure et postérieure, et surtout le corps vitré), qui équivaut à un abcès (fig. 2-5-22 ).
Fig. 2-5-22 Nature des endophtalmies. - –
Endophtalmie aiguë : 1 re semaine postopératoire (75 % ; suraiguë < 24 h).
- –
Endophtalmie subaiguë : 2 e à 6 e semaine.
- –
Endophtalmie chronique : après la 6 e semaine.
L’endophtalmie postopératoire aiguë est une urgence thérapeutique : le patient doit avoir reçu son injection intravitréenne d'antibiotiques au plus tard dans les 2 heures suivant son arrivée à l’hôpital (fig. 2-5-23 ).
ATB : antibiotique ; AV : acuité visuelle ; IV : voie intraveineuse ; IVT : injection intravitréenne ; PL : perception lumineuse.
- –
Biopsie du vitré (à l’aide d'un vitréotome portable en salle dédiée ou au vitréotome classique au bloc opératoire) ou ponction du vitré (aiguille orange 25 G, voire 21 G à ne faire pénétrer que de moitié de longueur, seringue de 2,5 ml) en fonction de l’existence d'une atteinte vitréenne importante, après avoir éliminé la présence d'un décollement de rétine à l’échographie (même si la ponction semble blanche, aspirer du balanced salt solution ou BSS pour recueillir le contenu de l’aiguille et envoyer immédiatement la seringue sans l’aiguille en bactériologie, puis réaliser une ponction de chambre antérieure ou PCA).
- –
Et/ou PCA, au moins 0,15 à 0,20 ml (aiguille de 27 ou 30 G, seringue de 2,5 ml).
- –
Injecter immédiatement le contenu de la seringue après avoir aspiré un peu de BSS pour recueillir le contenu de l’aiguille :
- •
0,10 à 0,15 ml dans un tube stérile pour réalisation d'une PCR panbactérienne ou universelle (ARN 16 S) si disponible [3–5]. Le French Institutional Endophthalmitis Study Group (FRIENDS) a récemment rapporté que la PCR panbactérienne présente une sensibilité comparable qu’elle soit réalisée sur vitré pur ou sur des prélèvements de vitré dilué [6] ;
- •
puis le reste dans un flacon d'hémoculture (pédiatrique si possible) aérobie (et si possible aussi anaérobie, surtout s’il s’agit d'une endophtalmie chronique). Il faut conserver à l’étuve le flacon d'hémoculture pendant 1 mois.
- •
- –
Frottis conjonctival éventuellement.
- –
Prélèvements de cornée en cas d'abcès cornéen.
- –
Elle est indiquée si le vitré n’est pas clair à l’examen clinique (la plus grande majorité des cas).
- –
Patient allongé, plutôt sous microscope opératoire, sous anesthésie topique – oxybuprocaïne (Novésine ® ) et/ou tétracaïne (Tétracaïne ® ) –, voire après injection sous-conjonctivale de xylocaïne non adrénalinée.
- –
Après antiseptie locale (identique à une chirurgie intra-oculaire) :
- •
vancomycine (Vancocine ® ) : 1 mg dans 0,05 ml de sérum physiologique (NaCl 0,9 %) [7] ;
- •
ceftazidime (Fortum ® ) : 2 mg dans 0,05 ml de sérum physiologique (NaCl 0,9 %) – possible en chambre antérieure (CA) si celle-ci est plate après PCA –, ou amikacine (Amiklin ® ) 0,20 mg dans certains cas particuliers [7, 8].
- •
- –
Dans deux seringues stériles de 1 ml séparées (pour éviter la précipitation des deux antibiotiques), aiguilles de 30 G :
- •
piquer à deux sites différents de la sclère, en évitant les deux méridiens horizontaux (risque de blessure des vaisseaux ciliaires longs) ;
- •
piquer à 4 mm du limbe (3,5 mm chez le pseudophaque) ;
- •
- –
PCA évacuatrice suivie d'un comprimé de Diamox ® après l’injection si l’œil est hypertone et/ou sans perception lumineuse.
- –
En l’absence d'amélioration : réinjections d'antibiotiques possibles à 2 à 3 jours d'intervalle, puis 1 fois par semaine pendant 2 semaines. Un patient reçoit en général 1 à 4 injections intravitréennes (IVT) au cours de son hospitalisation.
- –
À discuter. Plutôt à réaliser lors de la 2 e IVT (il n’existe pas d'intérêt à la réaliser d'emblée [9]) ; pas de réel bénéfice prouvé, mais une tendance à la diminution de la nécessité d'injections répétées d'antibiotiques [10].
- –
Possible dès la 1 re IVT si la situation clinique ne semble pas trop sévère (acuité visuelle conservée partiellement à 3-4/10 et vitré assez clair avec visibilité des vaisseaux de 2 e ordre au fond d'œil).
- –
Contre-indiquée en cas d'endophtalmie fongique (exceptionnelle).
- –
Injection dans une seringue séparée ou dans la même seringue que la Vancocine ® ou le Fortum ® (possible aussi en CA si celle-ci est plate après PCA). Certains auteurs préfèrent injecter de la dexaméthasone.
- –
Elle a une bonne pénétration intra-oculaire.
- –
Fluoroquinolone : lévofloxacine (Tavanic ® ) 1 comprimé de 500 mg/j – ou ciprofloxacine (Ciflox) 750 mg 2 fois/j en cas de bacilles à Gram négatif –, per os, pour une période de 6 semaines :
- •
demi-dose si insuffisant rénal ou hépatique ou âge > 70 ans ;
- •
contre-indiquée si : antécédents de tendinopathie, enfant < 15 ans, grossesse, allaitement ;
- •
précautions d'emploi en cas d'antécédents de convulsions et en cas de myasthénie.
- •
- –
Et imipénem + cilastatine (Tienam ® ) 500 mg 4 fois/j (3 fois/j si personnes âgées) en IVT (contre-indication si allergie aux pénicillines, attention aux allergies croisées avec les céphalosporines, allaitement et insuffisance rénale) pendant 1 semaine (hospitalisation), avec ou sans relais per os pour les 5 semaines suivantes (l’antibiothérapie devra être adaptée aux résultats bactériologiques).
- –
Si enfant/adolescent en phase de croissance : remplacer la fluoroquinolone par l’acide fusidique (Fucidine ® ) 50 mg/kg/j.
- –
Si allergie aux pénicillines ou si insuffisant rénal : remplacer le Tienam ® par la fosfomycine (Fosfocine ® ) 200 mg/kg/j, en perfusion d'une durée de 4 h chacune.
- –
1 ampoule de 4 mg (= 1 ml) par jour de bétaméthasone (Célestène ® ou Betnesol ® ).
- –
Injection systématique, d'emblée dès l’arrivée du patient.
- –
Par exemple :
- •
dexaméthasone/tobramycine collyre 6 fois/j ;
- •
dexaméthasone/néomycine/polymyxine B pommade 4 fois/j ;
- •
Atropine ® collyre 1 % 3 fois/j ;
- •
ciprofloxacine 6 fois/j.
- •
- –
Si ulcère ou abcès cornéen : collyre antibiotique renforcé (8 fois/j) et pas de collyre corticoïde pendant les 3–4 premiers jours.
- –
À but diagnostique (biopsie du vitré) et thérapeutique.
- –
D’emblée si l’acuité visuelle est limitée aux perceptions lumineuses (selon l’étude de l’Endophthalmitis Vitrectomy Study Group [8]), avec une cornée claire, une visualisation de l’iris suffisante et une non-visibilité des vaisseaux de 2 e ordre au fond d'œil.
- –
Par contre, il est classique de nos jours d'élargir les indications aux cas où l’acuité visuelle est inférieure à 1/10 [9, 10].
- –
Échographie oculaire mode B préalable pour éliminer l’existence d'un décollement de rétine associé.
- –
À but diagnostique (biopsie du vitré) et thérapeutique.
- –
Patient à jeun les matins suivants pour discuter la vitrectomie si l’état oculaire ne s’améliore pas et si l’acuité visuelle est limitée aux perceptions lumineuses [11] ou plus largement est inférieure à 1/10 [12, 13], avec cornée claire, visualisation de l’iris suffisante, et non-visibilité des vaisseaux de 2 e ordre au fond d'œil.
- –
Échographie oculaire mode B préalable pour éliminer l’existence d'un décollement de rétine associé.
- –
À discuter. Après avis interniste éventuellement.
- –
Bolus de méthylprednisolone (Solumédrol ® ) 500 mg/j pendant 3 jours, dès le 2 e jour du traitement par antibiotiques, avec perfusion lente sur au moins 1 h, contrôle de la tension artérielle et de la kaliémie principalement [11].
- –
± Relais per os sur 10 j.
N.B. : déclaration obligatoire auprès du Comité de lutte contre les infections nosocomiales (CLIN) du site opératoire en cas d'endophtalmies postopératoires (encadré 2-5-7 ).
Encadré 2-5-7
-
Prélever ++ et ensemencer + +
-
Injections intravitréennes de deux antibiotiques (± cortisone)
-
Antibiothérapie systémique
-
Injection sous-conjonctivale ou latérobulbaire de dexaméthasone
-
Traitement local (antibiotique + cortisone + cycloplégique/mydriatique)
-
Vitrectomie immédiate éventuelle
-
Les jours suivants, patient devant être à jeun le matin (avant la visite du matin, en cas de nécessité d'une vitrectomie secondaire en urgence)
- –
Origine : inspiré du chapitre 5.2.1 , paragraphe « Kératites infectieuses ».
- –
Type de protocole : protocole diagnostique, protocole de chemin clinique (organisationnel).
- –
Acteur(s) concerné(s) : médecin.
Le diagnostic de kératite infectieuse est évoqué devant un œil rouge, douloureux et/ou avec anomalie visuelle permanente, et/ou larmoiement, photophobie avec présence en biomicroscopie d'un infiltrat cornéen prenant la fluorescéine.
La prise en charge initiale dépend de la gravité de la kératite infectieuse et du terrain. Le logigramme de la figure 2-5-24 reprend les critères de gravité et la prise en charge initiale adaptée en fonction de ceux-ci. Dans tous les cas, il faut réaliser un prélèvement local pour diagnostic microbiologique (celui-ci peut faire l’objet d'un protocole ; voir ci-dessous).
ATB : antibiotique.
- –
Origine : protocole en vigueur au centre hospitalier national d'ophtalmologie des Quinze-Vingts (Dr E. Tuil).
- –
Type de protocole : protocole de procédure.
- –
Acteur(s) concerné(s) : ophtalmologiste, infirmier(ière).
- –
Le grattage cornéen est le prélèvement de référence ; il doit être effectué par l’ophtalmologiste à la lampe à fente avec un aide ; le port de gants est obligatoire.
- –
Un kit de prélèvement adapté doit être utilisé.
- –
Le grattage cornéen doit se porter sur la base et les berges de l’abcès.
Un ordre doit être respecté concernant les prélèvements :
- –
mycologie (avant anesthésie topique, si ce ne sont pas des unidoses, car le conservateur inhibe la culture des champignons) : à l’aide d'un écouvillon pour ensemencement sur milieu de Sabouraud sans inhibiteur (actidione) ;
- –
bactériologie, en deux parties :
- •
vaccinostyle : étalement fin sur la lame porte-objet pour examen direct ;
- •
écouvillon : gélose chocolat Polyvitex ® , milieu Portagerm ® .
- •
- –
amibes : lame de bistouri 15 inoxydable, lame porte-objet pour examen direct, et tube pour polymerase chain reaction (PCR) sans acide désoxyribonucléique (ADN) ni acide ribonucléique (ARN).
- –
virologie : éponge triangulaire stérile, tube pour PCR.
L’ensemble des prélèvements est transporté immédiatement au laboratoire de microbiologie. Boîtiers, lentilles et produits d'entretien sont également analysés.
- –
Origine : protocole en vigueur à l’OphtalmoPôle de Paris.
- –
Type de protocole : protocole de chemin clinique et thérapeutique.
- –
Acteur(s) concerné(s) : infirmier(ière) d'accueil et d'orientation, infirmier(ière), médecin.
- –
Homogénéiser le chemin clinique des patients présentant une cellulite orbitaire.
- –
Aider au bon usage des antibiotiques.
- –
Service d'ophtalmologie.
- –
Tout patient pris en charge dans le cadre d'une tuméfaction inflammatoire et douloureuse à caractère aigu de la totalité d'une ou de plusieurs paupières.
- –
Personnel médical (ophtalmologiste, radiologue, ORL) et paramédical.
- –
Patient.
- –
DPAR : déficit afférant pupillaire relatif.
- –
TDM : tomodensitométrie (scanner X).
- –
PEC : prise en charge.
- –
CS : consultation.
- –
ATB : antibiotique.
- –
PO/IV : per os/intraveineux.
- –
SARM : Staphylococcus aureus résistant à la méticilline.
- –
FDR : facteur de risque.
- –
Décret n° 2004-802 du 29 juillet 2004 du CSP relatif à l’exercice de la profession d'infimier(ière).
- –
Article R. 4311-5 du CSP : « 2° Aide à la prise des médicaments présentés sous forme non injectable, […] 5° Vérification de leur prise, 6° Surveillance de leurs effets et éducation du patient, […] 32° Surveillance de patients ayant fait l’objet de ponction à visée diagnostique ou thérapeutique ».
- –
Classification de Chandler [14].
- –
Encyclopédie médico-chirurgicale (EMC) – Ophtalmologie, article 21-650-A-15 [15].
- –
Dossiers de soins infirmiers et médical.
- –
Solution hydro-alcoolique.
- –
Compresses.
- –
Flacons de collyres.
- –
Matériel de perfusion (cathlon, tubulure).
- –
Gants.
- –
Réceptacle à déchets.
- –
Source lumineuse ponctuelle portable.
- –
Thermomètre pour l’évaluation de la température centrale.
- –
Accès au plateau d'exploration tomodensitométrique.
- –
Accès à une salle de chirurgie à qualification minimale
ISO 8.
- –
Indications : sur prescription médicale.
- –
Contre-indications : allergies aux antibiotiques, hypersensibilité à l’un des collyres.
- –
Contre-indication relative : liée aux pathologies (par exemple aggravation sous traitement).
- –
Proscrire le port de lentilles de contact pendant la durée du traitement.
- –
S’enquérir de la posologie diurne et nocturne.
- –
S’enquérir de la conservation des collyres.
- –
S’enquérir des allergies médicamenteuses, en particulier aux antibiotiques.
- –
Ne pas prolonger le traitement au-delà de la date prévue par le médecin et respecter strictement la prescription.
- –
Prévenir le médecin en cas d'apparition d'irritation persistante et prolongée au cours du traitement.
- –
S’assurer de l’absence d'intolérance liée au traitement après chaque administration.
- –
Pour un traitement ambulatoire, informer le patient des effets indésirables possibles du traitement prescrit et de leur autosurveillance.
- –
Pour un traitement hospitalisé, vérifier l’efficacité du traitement (diminution de la douleur).
- –
Alerter, tracer les effets indésirables.
Voir fig. 2-5-25 .
ATB : antibiotique ; DPAR : déficit afférent pupillaire relatif ; FDR : facteur de risque ; IV : (voie) intraveineuse ; PEC : prise en charge ; PO : per os ; SARM : Staphylococcus aureus résistant à la méticilline ; TDM : tomodensitométrie.
- –
Doses antibiotiques adulte pour le traitement des cellulites orbitaires :
- •
vancomycine : 30 mg/kg 2 fois/j (concentration cible 15-20 ug/ml) ;
- •
ceftriaxone : 2 g/j en 1 injection ;
- •
métronidazole : 1 g/12 h ;
- •
fosfomycine : 100-200 mg/kg/j ;
- •
clindamycine : 600 mg/6-8 h au maximum.
- •
- –
Doses antibiotiques enfant pour le traitement des cellulites orbitaires :
- •
amoxicilline + acide clavulanique : 30 mg/kg 3 fois/j PO ou IV en fonction de la clinique (maximum 1,2 g/dose) ;
- •
ceftriaxone : 100 mg/kg/j IV en 2 fois ;
- •
métronidazole : 30 mg/kg/j IV en 4 fois ;
- •
vancomycine : 40 à 60 mg/kg/j IV en 3 à 4 fois (maximum 4 g) ;
- •
clindamycine : 20 à 30 mg/kg/j en 3 prises (maximum 600 mg par prise) ;
- •
flucloxacilline IV : 200 mg/kg/j IV en 4 fois.
- •
- –
Si thrombophlébite du sinus caverneux : héparinothérapie.
- –
Si origine sinusienne : décongestionnant nasal + lavages des fosses nasales.
- –
Si diabète, immunodéprimé avec syndrome de l’apex : infection fongique possible, prendre un avis infectiologue.
- –
Recherche des facteurs de risque de SARM : hospitalisation récente, antibiothérapie récente, cathéter à chambre implantable, insuffisance rénale chronique dialysée, diabète.
- –
Origine : chapitre 5.2.3 .
- –
Type de protocole : protocole diagnostique, protocole thérapeutique.
- –
Acteur(s) concerné(s) : médecin.
Le diagnostic de crise aiguë de fermeture de l’angle (CAFA) est évoqué devant un œil douloureux et/ou rouge et/ou associé à une altération visuelle permanente et un œil douloureux. L’examen objective une pression intra-oculaire (PIO) très élevée et la gonioscopie, la présence d'une fermeture de l’angle irido-cornéen (AIC) et/ou d'une buée épithéliale et/ou d'une semi-mydriase aréflexique.
Il s’agit d'une urgence médicale.
La prise en charge comprend trois axes :
- –
diminution rapide de la PIO et contrôle de l’inflammation :
- •
mannitol à 20 %%, 100 à 200 ml en IV en 15 minutes, 1 à 2 g/kg de poids sous contrôle de la TA et de la fréquence cardiaque, et en l’absence de contre-indication (insuffisance cardiaque ou rénale, déshydratation importante, allergie) ;
- •
acétazolamide (Diamox ® ), 1 ampoule en IV lente puis relais PO, 1 comprimé (250 mg) toutes les 8 heures associé à une supplémentation potassique et en l’absence de contre-indication (insuffisance rénale grave, hypokaliémie, diabète décompensé, allergie aux sulfamides, acidose métabolique hyperchlorémique) ;
- •
collyres antiglaucomateux locaux (β-bloquants, α 2 -adrénergiques, inhibiteurs de l’anhydrase carbonique) ;
- •
anti-inflammatoires stéroïdiens ;
- •
antalgiques et antiémétiques.
- •
- –
modification de la configuration de l’AIC et prévention des récurrences :
- •
pilocarpine à 2 %, une goutte toutes les 15 min jusqu’à l’obtention d'un myosis, puis une goutte toutes les 6 à 8 heures jusqu’à la réalisation de l’iridotomie. Tant que la PIO est élevée (> 40 mmHg), le traitement local reste inefficace ;
- •
en fonction de la gonioscopie :
- –
si l’angle est rouvert sur plus de 180°, une iridotomie au laser sera réalisée ;
- –
en présence de synéchies antérieures sur plus de 180°, cette iridotomie deviendra inutile, voire dangereuse et une intervention de trabéculectomie ou combinée phaco-trabéculectomie doit être envisagée.
- –
- •
- –
prise en charge de l’œil controlatéral : pilocarpine 1 %, une goutte toutes les 8 heures dès le diagnostic et jusqu’à la réalisation d'une iridotomie périphérique.
Toute situation d'urgence qui se reproduit régulièrement peut faire l’objet d'un protocole. Il faut au préalable qu’un besoin explicite des professionnels de soins ou des patients existe. Il doit être consensuel, étayé par les données scientifiques existantes. Un protocole permet d'améliorer la qualité des pratiques aux urgences ainsi que de les homogénéiser, de les sécuriser et de les accélérer dans de multiples champs tels que l’accueil, l’information, le chemin clinique, le soin courant, la thérapeutique ou l’orientation des patients.
[1] HAS. Comment élaborer et mettre en oeuvre des protocoles pluriprofessionnels ? Février 2015. En ligne : https://www.has-sante.fr/portail/jcms/c_2033014/fr/commentelaborer- et-mettre-en-oeuvre-des-protocoles-pluriprofessionnels
[2] Bourges JL. Urgences ophtalmologiques dans les centres hospitaliers universitaires français. J Fr Ophtalmol 2017.
[3] Cornut PL, Boisset S, Romanet JP, et al. Principles and applications of molecular biology techniques for the microbiological diagnosis of acute post-operative endophthalmitis. Surv Ophthalmol 2014 ; 59 : 286‑303.
[4] Chiquet C, Cornut PL, Benito Y, et al. Eubacterial PCR for bacterial detection and identification in 100 acute postcataract surgery endophthalmitis. Invest Ophthalmol Vis Sci 2008 ; 49 : 1971‑8.
[5] Liu C, Ji J, Li S, et al. Microbiological isolates and antibiotic susceptibilities : a 10-year review of culture-proven endophthalmitis cases. Curr Eye Res 2017 ; 42 : 443‑7.
[6] Chiquet C, Maurin M, Thuret G, et al. Analysis of diluted vitreous samples from vitrectomy is useful in eyes with severe acute postoperative endophthalmitis. Ophthalmology 2009 ; 116 : 2437‑41.e1.
[7] Schimel AM, Miller D, Flynn HW Jr. Endophthalmitis isolates and antibiotic susceptibilities : a 10-year review of culture-proven cases. Am J Ophthalmol 2013 ; 156 : 50‑2.e1.
[8] Cornut PL, Chiquet C. Injections intravitréennes d’antibiotiques et endophtalmies. J Fr
Ophtalmol 2008 ; 31(8) : 815‑23.
[9] Koehrer P, Bron AM, Chiquet C, et al. Early versus delayed intravitreal betamethasone as an adjuvant in the treatment of presumed postoperative endophthalmitis : a randomised trial. Br J Ophthalmol 2016 ; 100 : 1076‑80.
[10] Moisseiev E, Abbassi S, Park SS. Intravitreal dexamethasone in the management of acute endophthalmitis : a comparative retrospective study. Eur J Ophthalmol 2017 ; 27 : 67‑73.
[11] Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol 1995 ; 113 : 1479‑96.
[12] Kuhn F, Gini G. Ten years after… are findings of the Endophthalmitis Vitrectomy Study still relevant today ? Graefes Arch Clin Exp Ophthalmol 2005 ; 243 : 1197‑9.
[13] Gower EW, Keay LJ, Stare DE, et al. Characteristics of endophthalmitis after cataract surgery in the united states medicare population. Ophthalmology 2015 ; 122 : 1625‑32.
[14] Chandler JR, Langenbrunner DJ, Stevens ER. The pathogenesis of orbital complications in acute sinusitis. The Laryngoscope 1970 ; 80 : 1414‑28.
[15] Mouriaux F, Rysanek B, Cattoir V, Babin E. Infections orbitaires. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, 21‑650-A-15. 2011 : 1‑9.
[16] Gappy C, Archer SM, Barza M. Orbital cellulitis. 2016. En ligne :https://www.uptodate. com/contents/orbital-cellulitis
Anesthésie pour urgences ophtalmologiques de l’adulte
G. GUERRIER
-
Une coopération optimale entre ophtalmologistes et anesthésistes conditionne le pronostic visuel du patient.
-
La stratégie anesthésique repose sur le degré d'urgence, le délai de prise en charge, l’état général du patient, les comorbidités, le jeûne préopératoire et les traitements pris.
-
Compléter une anesthésie générale par une anesthésie locorégionale permet d'obtenir une sécurité peropératoire accrue et un confort postopératoire optimal.
-
L’anesthésie caronculaire semble plus efficace et plus sûre que l’anesthésie péribulbaire.
La proportion de patients hospitalisés en urgence avec une indication chirurgicale représente 20 à 40 % des admissions pour raison ophtalmologique en France [1]. Les anesthésistes affiliés à un service d'urgence sont donc régulièrement impliqués dans la prise en charge des urgences ophtalmologiques et doivent en connaître les spécificités. Une coopération optimale entre ophtalmologistes et anesthésistes conditionne le pronostic visuel des patients. Le degré d'urgence, les délais de prise en charge, l’état général des patients, l’existence de comorbidités, l’état de jeûne préopératoire et la prise éventuelle de traitements sont les déterminants principaux du choix raisonné de la stratégie anesthésique.
L’anesthésie générale (AG) est la technique recommandée en cas d'urgence chirurgicale ophtalmologique qui ne peut être différée sans compromettre le pronostic fonctionnel. Elle garantit une immobilité parfaite de la région opératoire sans nécessiter la coopération du patient et sans contrainte de temps opératoire chez un patient qui n’est pas forcément à jeun. Elle n’expose pas au risque d'accident de ponction liée à l’anesthésie locorégionale et reste la technique de référence pour l’exploration des plaies du globe et des voies lacrymales. L’intubation trachéale est la méthode privilégiée pour ventiler les patients en assurant le contrôle des voies aériennes supérieures du fait de l’absence d'accès à la tête après la mise en place des champs opératoires.
La réalisation d'une anesthésie générale chez un patient à estomac plein en urgence est une situation à haut risque d'inhalation du contenu gastrique dont la gravité potentielle est bien documentée. Elle nécessite le recours à une procédure dite en séquence rapide selon les recommandations de la Société française d'anesthésie réanimation (SFAR). L’objectif de cette technique est d'assurer le contrôle des voies aériennes le plus rapidement possible à l’aide d'une intubation trachéale. Elle associe un agent hypnotique à un curare d'action rapide et de brève durée d'action pour permettre un retour à une ventilation spontanée en cas d'échec d'intubation.
En cas de traumatisme oculaire, une attention particulière devra être portée sur l’existence de lésions associées extra-ophtalmologiques touchant la face et exposant au risque d'intubation difficile. Cette situation nécessite le recours à une induction en séquence rapide en présence d'un anesthésiste entraîné aux intubations sous fibroscopie. Le masque laryngé pour ventiler les patients présente un intérêt majeur en cas d'intubation difficile prévisible car son insertion est facile et permet de s’affranchir des difficultés potentielles d'exposition glottique pour intuber. De plus, ce dispositif présente l’avantage d'induire une élévation moins importante de la pression intra-oculaire (PIO) que celle provoquée par l’intubation [2] et le réveil se fait sans effort de toux (vidéo 2-6-1) [3]. Cependant, comme pour toute microchirurgie, l’immobilité absolue sur la table est une priorité conditionnée par le maintien d'une anesthésie profonde. L’estomac plein, le reflux gastro-œsophagien, une chirurgie hémorragique du rhinopharynx et les malformations pharyngées sont les principales contre-indications des dispositifs supraglottiques. Ils n’ont donc pas de place dans la prise en charge d'un patient qui n’est pas à jeun.
La succinylcholine est le seul curare d'action rapide et de durée brève disponible sur le marché. Les fasciculations musculaires induites par ce produit dépolarisant ont longtemps été suspectes d'augmenter la PIO [4]. On sait maintenant que le risque théorique d'aggravation des lésions oculaires lors d'une anesthésie générale réalisée en urgence est faible pour plusieurs raisons. D’abord, l’augmentation de la PIO induite par la succinylcholine est limitée dans son amplitude et en durée (augmentation de 5 à 10 mmHg pendant 6 minutes). De plus, aucune étude n’a pu objectiver l’aggravation des lésions traumatiques par la succinylcholine chez l’homme ou sur modèle animal [5, 6]. Enfin, un agent hypnotique qui assure une stabilité voire une baisse de la PIO est toujours injecté de façon concomitante à la succinylcholine [7]. En outre, le rocuronium – curare non dépolarisant de durée d'action intermédiaire – est maintenant utilisable pour réaliser une séquence rapide en cas de contre-indication à la succinylcholine dans la mesure où un antagoniste spécifique (le sugammadex) est désormais disponible en cas d'intubation impossible. Comme tous les autres curares non dépolarisants, le rocuronium présente un risque allergique inférieur à celui lié à une exposition à la succinylcholine. Quel que soit le choix du curare pour intuber un patient avec estomac plein, le risque vital d'une inhalation du contenu gastrique prime sur le risque théorique fonctionnel oculaire. Tous les autres agents anesthésiques intraveineux diminuent la PIO, particulièrement le thiopental et le propofol. La kétamine utilisée seule augmente la PIO. Cet effet s’annule lors de l’administration conjointe d'une benzodiazépine. Les anesthésiques halogénés diminuent la PIO de manière concentration-dépendante [8]. Le protoxyde d'azote n’a pas d'effet propre sur la PIO mais peut s’expandre dans le segment postérieur responsable d'hypertonie oculaire. Les morphiniques diminuent très légèrement la PIO en raison de leur effet myotique, facilitant ainsi le drainage de l’humeur aqueuse.
En cas d'urgence chirurgicale relative, un délai de 6 heures permettra de réaliser une anesthésie locorégionale (ALR) chez un patient à jeun qui ne présente pas de contre-indications à ce type d'anesthésie. D’une manière générale, une ALR est envisagée préférentiellement à une AG, à la fois pour des raisons de sécurité mais aussi de contraintes économiques et temporelles. En effet, la réalisation d'une ALR peut se faire dans une salle d'induction préopératoire et permettre ainsi d'optimiser le flux des malades. De plus, le coût global d'une ALR est moindre que celui d'une AG. Par ailleurs, l’existence de comorbidités cardiorespiratoires expose au risque de complications liées à l’AG. Néanmoins, le bénéfice de l’ALR sur l’AG en termes de complications péri-opératoires nécessite d'être spécifiquement exploré en chirurgie ophtalmologique. Il est utile de préciser que l’association d'une anesthésie péribulbaire à une AG pour chirurgie vitréorétinienne permet de réduire l’incidence du réflexe oculocardiaque peropératoire et d'obtenir un meilleur confort postopératoire en termes d'analgésie et de nausées/vomissements [9]. Le choix du type d'anesthésie en fonction du degré d'urgence et de l’état de jeûne du patient est présenté dans le tableau 2-6-1.
| Urgence chirurgicale | |||
|---|---|---|---|
| Absolue | Relative | ||
| Patient | À jeun | Anesthésie générale et/ou locorégionale | Anesthésie générale et/ou locorégionale |
| Non à jeun | Anesthésie générale séquence rapide | ||
1 Solides > 6 heures; liquides clairs (eau, thé sans lait, café sans lait, jus sans pulpe) > 2 heures.
2 Plaie de globe, plaie des voies lacrymales, plaie de paupière.
3 Décollement de rétine sans décollement de la macula, endophtalmie, glaucome par fermeture de l'angle, reprise chirurgicale (luxation du cristallin après chirurgie de la cataracte).
4 Le choix se fera en fonction des contre-indications propres à chaque technique et des préférences du patient.
Deux techniques principales d'ALR sont actuellement pratiquées par les anesthésistes en France : l’anesthésie extraconique ou péribulbaire et l’anesthésie caronculaire. L’anesthésie péribulbaire (APB) a été développée pour éviter d'introduire une aiguille dans l’espace intraconique où transitent la plupart des éléments vulnérables de l’orbite. Un grand volume d'anesthésique local (10 ml) est nécessaire pour assurer une diffusion périorbitaire, mais aussi vers les paupières, évitant le recours à un bloc facial de complément. La technique consiste à effectuer deux injections de 5 ml, l’une inférolatérale et l’autre supéromédiale [10]. L’anesthésie caronculaire est une technique plus récemment décrite consistant en une ponction unique au canthus médial de l’œil qui semble plus efficace [11] et plus sûre que l’APB. Cette dernière technique peut avantageusement être réalisée par le chirurgien lui-même, alors que le patient est installé sur la table d'opération (vidéo 2-6-2).
La technique d'injection rétrobulbaire (ou intraconique postérieure), pratiquée à l’origine et très efficace, ne devrait actuellement plus être pratiquée compte tenue d'une incidence de complications considérée comme trop élevée. Néanmoins, toutes les complications connues avec l’anesthésie rétrobulbaire ont été rapportées avec les autres techniques impliquant l’insertion d'une aiguille dans l’orbite. La nature des complications propres à l’ALR varie selon la technique utilisée et le site d'injection pratiqué mais dépend beaucoup de l’expérience et de la connaissance anatomique de l’anesthésiste. Une formation spécifique à ces techniques d'anesthésie est donc primordiale. Perforation de globe et hématome sont les deux complications qui peuvent nécessiter une prise en charge chirurgicale en urgence.
La fréquence de survenue des perforations du bulbe au cours d'une anesthésie péribulbaire est faible (1/1 000 à 1/12 000) [12, 13]. Il faut distinguer les perforations (point d'entrée et de sortie du globe avec injection d'anesthésique extraoculaire) et les pénétrations (point d'entrée unique et risque d'injection intra-oculaire). Une perforation non immédiatement diagnostiquée entraînant un retard de prise en charge engage le pronostic fonctionnel. Des symptômes tels que douleur aiguë, phosphènes, hypotonie subite du globe et hémorragie vitréenne doivent faire suspecter un événement iatrogénique. Les principaux facteurs de risque de perforation sont la présence d'un staphylome myopique, les ponctions multiples et l’inexpérience de l’opérateur [14]. La pratique de réinjections multiples pour tenter de parfaire une akinésie incomplète est donc source de complications. Mieux vaut se limiter à trois injections au plus et éventuellement compléter l’anesthésie avec une injection sous-ténonienne d'anesthésique local.
L’augmentation de la PIO, générée par un hématome rétrobulbaire artériel compressif ou par l’injection elle-même, peut entraîner une ischémie rétinienne. L’incidence des hématomes intraconiques est variable selon les estimations (1/5000 à 1/50) [12]. Une plaie artérielle à l’intérieur du cône fasciomus-culaire peut être responsable d'un hématome artériel potentiellement compressif et nécessitant un tamponnement externe voire une canthotomie de décompression. Un hématome d'origine veineuse bénin survient plus fréquemment. La présence d'un trouble de coagulation, la prise d'un anticoagulant ou d'un antiplaquettaire ne semble pas modifier le risque d'hématome ni son pronostic [15]. Un traumatisme direct du nerf optique par l’aiguille est une complication rarissime mais de mauvais pronostic fonctionnel.
Ce type d'anesthésie est évidemment réservé aux indications de chirurgie du segment antérieur ou pour permettre l’examen d'un œil douloureux dans un contexte d'urgence. L’intérêt majeur de cette technique est l’absence totale de complications liées à l’anesthésie locorégionale. La récupération visuelle est immédiate, car l’absence de tout bloc moteur permet d'éviter le port d'un pansement occlusif. L’analgésie est cependant parfois insatisfaisante. L’éblouissement provoqué par la lumière du microscope peut être inconfortable. Il n’y a aucune akinésie ni aucun effet sur la PIO. La durée de l’intervention est théoriquement limitée à 10 minutes [16]. Ces contraintes peuvent rendre l’intervention chirurgicale moins aisée et altérer la satisfaction des patients qui semble corrélée à l’adjonction d'une sédation lors des temps opératoires douloureux d'une intervention pratiquée sous anesthésie topique [17]. En France, seule la tétracaïne et l’oxybuprocaïne ont l’autorisation de mise sur le marché (AMM) dans cette indication, bien que la lidocaïne sans conservateur soit également utilisée. Les collyres employés contiennent une concentration élevée de principe actif. Les effets secondaires systémiques sont exceptionnels mais intenses (troubles du rythme graves, convulsions) [18], liés au caractère très vascularisé de la muqueuse des fosses nasales responsable d'une résorption du collyre entraîné par le flux lacrymal. L’utilisation d'un gel visqueux urologique de lidocaïne ou l’emploi d'éponges imbibées d'anesthésique local que l’on dépose dans les culs-de-sac conjonctivaux semblent améliorer la qualité de l’analgésie [19]. L’anesthésie topique est parfois associée à une sédation intraveineuse, confinant parfois à l’anesthésie générale, avec les risques inhérents à cette technique.
L’espace épiscléral (espace de Tenon) est un espace virtuel libre de toute adhérence qui entoure la portion sclérale du bulbe. Lors de l’injection d'un faible volume d'anesthésique local (3 ml), la diffusion du produit se fait de manière circulaire autour du globe [20]. Les nerfs ciliaires qui transitent par l’espace épiscléral sont donc anesthésiés à l’origine du bloc sensitif du bulbe. La continuité entre la gaine du bulbe et les gaines aponévrotiques des muscles droits explique la possibilité d'obtenir une akinésie et un bloc de l’orbiculaire à condition d'augmenter le volume d'anesthésique local injecté [21]. Si elle est bien maîtrisée, cette technique sûre peut être utilisée seule pour l’ensemble de la chirurgie intra-oculaire [22], notamment dans un contexte d'urgence chez un patient qui présente à la fois des contre-indications à la réalisation d'une ALR et d'une AG. La survenue d'un chémosis et celle d'un hématome sous-conjonctival sont deux complications possibles de cette approche.
Un mélange équilibré associant un produit d'action intermédiaire (mépivacaïne 2 % par exemple) et un produit d'action prolongé (ropivacaïne 0,75 % par exemple) est habituellement utilisé en France. La nature urgente de l’indication chirurgicale n’a pas d'impact sur le choix des produits utilisés pourvu qu’ils assurent une anesthésie et une akinésie satisfaisantes assortie d'une analgésie postopératoire optimale. La hyaluronidase, qui permettait de faciliter la diffusion des anesthésiques locaux et d'améliorer la qualité du bloc quelle que soit la technique utilisée [23], n’est plus disponible en France. Aucun produit de substitution n’a pour l’instant montré une efficacité équivalente à cette enzyme retirée du marché pour des raisons de sécurité sanitaire (risque allergique et transmission d'agents non conventionnels). Cette lacune est particulièrement problématique en cas de chirurgie pratiquée sur un œil déjà opéré autour duquel la diffusion de la solution anesthésique est inhomogène. Contrairement aux anesthésies locorégionales réalisées dans d'autres disciplines chirurgicales comme l’orthopédie, la place de la dexaméthasone est encore mal précisée mais pourrait améliorer la qualité de l’anesthésie péribulbaire et prolonger la durée du bloc. De plus, l’adjonction de dexaméthasone dans l’espace péribulbaire pourrait avoir un bénéfice potentiel direct sur la diminution des récidives des décollements de rétine par réduction de la prolifération vitréorétinienne [24].
La consultation pré-anesthésique a été rendue obligatoire par le décret n° 94-1050 du 5 décembre 1994 et doit se faire 48 heures au moins avant toute chirurgie programmée. L’indication chirurgicale urgente fait exception et l’évaluation du patient et son information concernant les modalités anesthésiques peuvent se faire le même jour que l’intervention. Le chirurgien doit néanmoins motiver sa décision et caractériser le degré d'urgence. Aucun bilan biologique systématique n’est recommandé, en particulier un bilan d'hémostase. La chirurgie ophtalmologique n’interfère pas avec les grandes fonctions vitales, ce qui rend la prescription d'examens plus complexes rarement nécessaire. D’autres examens complémentaires sont à demander au cas par cas, notamment un ionogramme sanguin à la recherche d'une hypokaliémie en cas de prise d'acétazolamide. Un scanner cérébral devra être réalisé systématiquement à la recherche de lésions associées extra-ophtalmologiques en cas de traumatisme oculaire.
Les sujets âgés peuvent présenter une altération multiple des grandes fonctions vitales et sont souvent l’objet d'une polymédication interférant potentiellement avec les agents anesthésiques. Cependant, la mortalité et la morbidité cardiovasculaires péri-opé-ratoires observées en chirurgie ophtalmologique sont plus faibles que dans toutes les autres formes de chirurgie confondues [25]. Les patients porteurs d'une insuffisance respiratoire chronique devront bénéficier d'une structure d'aval en cas de sevrage ventilatoire difficile prévisible.
Les patients admis pour exploration de plaie oculaire sont souvent en état d'ébriété [26]. Un patient présentant une intoxication aiguë alcoolique est à traiter comme un patient à estomac plein en imposant donc le protocole préoxygénation, injection d'un hypnotique et d'un curare d'action rapide avec manœuvre de Sellick (pression cricoïdienne externe pour comprimer l’œsophage et réduire le risque d'inhalation). L’intoxication alcoolique aiguë nécessite de diminuer les doses d'agents hypnotiques et morphiniques nécessaires à l’induction. Lorsque l’urgence est différée et le patient laissé à jeun, il est nécessaire de prévenir un éventuel syndrome de sevrage en cas d'intoxication chronique par une importante hydratation et des benzodiazépines. On profitera de l’hospitalisation pour pallier des carences vitaminiques possibles (vitamine B1 pour prévenir l’encéphalopathie de Gayet-Wernicke et vitamine B6 pour prévenir les neuropathies périphériques).
La nécessité de corriger une anticoagulation médicamenteuse est aujourd'hui largement remise en cause, que la chirurgie soit réglée ou urgente, y compris en cas d'ALR. La contre-indication de l’ALR chez le patient sous antiplaquettaire ou sous anticoagulant est relative. L’orbite n’étant pas un espace clos, les hématomes peuvent diffuser largement dans les tissus sous-cutanés limitant le risque de compression. L’hématome artériel rétrobulbaire potentiellement compressif semble plus dépendre d'une anomalie vasculaire acquise de type athéromateux ou diabétique que d'une anomalie de coagulation. Un hématome iatrogène régresse le plus souvent sans séquelle et n’empêche pas forcément la réalisation de l’intervention. Le risque hémorragique n’est pas connu avec les nouveaux anticoagulants oraux, tels que le dabigatran, le rivaroxaban et l’apixaban.
La chirurgie ophtalmologique est d'autant plus anxiogène qu’elle est réalisée dans un contexte d'urgence [27]. L’évaluation de l’anxiété préopératoire et du profil psychologique du malade est indispensable et doit permettre de choisir avec le patient la technique anesthésique la plus adaptée, avec ou sans l’aide d'une prémédication à visée anxiolytique.
Le principe de l’antibioprophylaxie repose sur l’administration d'un antibiotique avant une intervention chirurgicale dans le but de diminuer le risque d'infection du site opératoire. Cette pratique relève à la fois de la responsabilité du chirurgien et de l’anesthésiste. En chirurgie ophtalmologique, l’intérêt de la démarche est de réduire le risque d'endophtalmie mais l’antibioprophylaxie n’est pas systématique. Il appartient donc au chirurgien et à l’anesthésiste d'évaluer au cas par cas les bénéfices et les risques liés à l’administration d'une antibioprophylaxie.
Aucune étude concernant l’intérêt de l’antibioprophylaxie autre que les traumatismes oculaires n’est disponible à ce jour. L’analogie avec les facteurs de risque d'endophtalmie après chirurgie de la cataracte (diabète [28], immunodépression) n’est pertinente que dans la mesure où un matériel implantable est laissé en place (par exemple, éponge pour décollement de rétine). La voie orale présente l’avantage de donner un pic de concentration intraoculaire prolongé. Une fluoroquinolone administrée par voie orale représente le meilleur compromis. Une prise de 500 mg de lévofloxacine 12 heures et 2 heures avant la chirurgie permet d'atteindre des concentrations dans le vitré supérieures aux concentrations minimales inhibitrices des micro-organismes en cause dans les endophthalmies [29]. Les fluoroquinolones sont susceptibles d'entraîner notamment des ruptures tendineuses (rupture du tendon d'Achille, surtout chez la personne âgée ou sous corticoïdes), des allergies et une photosensibilité. De plus, la moxifloxacine pouvant entraîner certains troubles du rythme cardiaque (torsades de pointe), elle est notamment contre-indiquée en cas d'espace QT allongé.
Compte tenu du risque élevé d'augmentation de la pression de sélection de mutants résistants, l’usage de l’antibioprophylaxie systémique est réservé aux patients présentant des facteurs de risque d'endophtalmie. Lors d'une chirurgie à globe ouvert (chirurgie du glaucome, vitrectomie) avec présence de facteur de risque infectieux, une antibioprophylaxie par lévofloxacine semble légitime (tableau 2-6-2). Le risque d'endophtalmie après chirurgie à globe fermé sans complications (chirurgie de l’orbite, des paupières ou des voies lacrymales ; chirurgie de la conjonctive) est quasi nul. Aucune antibioprophylaxie préopératoire n’est justifiée.
| Indication chirurgicale | Agent anti-infectieux | Posologie | Voie d'administration |
|---|---|---|---|
| Chirurgie à globe ouvert avec facteur de risque infectieux ou situation à risque | Lévofloxacine | 500 mg 12 h et 2 h avant chirurgie | PO |
| Traumatisme à globe ouvert | Lévofloxacine | 500 mg | IV à J1 et PO à J2 |
| Traumatisme à globe ouvert avec plaie souillée | Lévofloxacine en association avec soit: | 500 mg | IV à J1 et PO à J2 |
| 1 mg + 2,25 mg | Intravitréene J1 | |
| 1 mg + 200 ug | Intravitréene J1 | |
| Plaies des voies lacrymales | Penicilline A + inhibiteur de β-lactamase | 2 g | IV |
| Clindamycine si allergie | 600 mg | IV | |
| Chirurgie à globe fermé | Pas d'antibioprophylaxie |
* Diabète, immunodépression, œil multiopéré, monophtalmie.
La prescription d'une antibioprophylaxie en cas de plaie du globe pour prévenir le risque d'endophtalmie est généralement admise, même si une étude bien conduite a montré l’absence de bénéfice d'une telle pratique [30]. L’antibioprophylaxie doit être réalisée avec des antibiotiques d'administration facile, possédant une bonne diffusion intra-oculaire, un spectre antibactérien adapté aux micro-organismes le plus fréquemment en cause dans les endophtalmies, et d'un niveau d'efficacité clinique estimé acceptable compte tenu de leur sécurité d'emploi. Le risque de contamination dans les traumatismes oculaires à globe ouvert est d'autant plus grand que le délai de prise en charge est tardif (> 72 heures), qu’il existe une hernie de tissu uvéal ou une lacération cornéosclérale [31]. La présence d'un corps étranger intra-oculaire ne semble pas être pas un facteur de risque supplémentaire de complication infectieuse. Une antibioprophylaxie intraveineuse initiale est donc justifiée précocement et poursuivie pendant 24 heures, voire plus si nécessaire en fonction de l’évolution clinique. Actuellement, la lévofloxacine paraît être une solution satisfaisante, compte tenu de ses caractéristiques pharmacocinétiques et pharmacodynamiques. En cas de plaie manifestement très souillée, une injection intravitréenne (association vancomycine et ceftazidime ou amikacine) en fin d'intervention doit être envisagée (tableau 2-6-2) [32].
Afin de préserver les sutures chirurgicales et limiter les élévations de PIO au réveil, il est préférable d'éviter les efforts de toux lors de l’extubation après une AG (vidéo 2-6-3), ainsi que les efforts de vomissement postopératoire. Ces deux événements sont susceptibles de provoquer des pics de PIO élevés. L’incidence des nausées/vomissements postopératoires est élevée en ophtalmologie (entre 16 et 76 % selon le type de chirurgie) [33]. Ils sont particulièrement fréquents pour la chirurgie du décollement de rétine et potentialisés par la douleur et l’hypertonie oculaire que l’on retrouve fréquemment après un décollement de rétine. Ainsi, une stratégie de prévention doit être mise en œuvre, en incluant les antiémétiques intraveineux tels que l’ondansétron, la dexaméthasone et les hypotoniants systémiques. De petites doses de lidocaïne intraveineuse (1 à 2 mg/kg) limitent le réflexe de toux lié à l’irritation de la sonde endotrachéale. La lidocaïne, sous forme de gel appliqué autour du ballonnet des sondes d'intubation [34] ou sous forme aqueuse pour gonfler le ballonnet [35], constitue un moyen efficace de limiter l’incidence des efforts de toux à l’extubation.
La douleur postopératoire est classiquement considérée à tort comme minime en chirurgie ophtalmologique, et reste de ce fait particulièrement mal documentée. L’intensité de la douleur préopératoire, l’anesthésie générale et l’autodépréciation de l’état de santé semblent être des facteurs de risque indépendants de douleurs postopératoires [36]. Apprécier le niveau de douleur préopératoire, la qualité descriptive de l’état de santé des patients, et associer une anesthésie topique ou locorégionale à une AG pourraient être utiles afin d'optimiser la gestion de la douleur postopératoire. Aucune donnée n’est disponible concernant la gestion de la douleur des urgences ophtalmologiques, qu’elles soient médicales ou chirurgicales.
Les anesthésistes sont toujours impliqués dans la gestion de la douleur péri-opératoire des urgences ophtalmologiques chirurgicales. En revanche, la douleur potentiellement induite par les pathologies strictement médicales (kératites, uvéites, etc.) est le plus souvent traitée par les ophtalmologistes. Or le maniement optimal des produits antalgiques réclame une formation spécifique dont les ophtalmologistes n’ont pas forcément bénéficié. De manière réciproque, les spécificités des mécanismes algogènes au niveau oculaire sont parfois méconnues des anesthésistes. Par ailleurs, l’anxiété induite par le contexte de l’urgence et de la pathologie oculaire rend la gestion de l’analgésie d'autant plus difficile qu’elle abaisse le seuil douloureux [37]. À notre connaissance, aucune donnée publiée concernant la qualité de la prise en charge de la douleur des urgences médicales ophtalmologiques n’est disponible. Un état des lieux suivi d'une étude évaluant l’impact d'une initiation pratique sur l’analgésie multimodale dédiée aux ophtalmologistes et d'une formation des anesthésistes aux mécanismes de la douleur en ophtalmologie pourrait certainement bénéficier aux patients.
Les complications oculaires en chirurgie non ophtalmologique sont rares (5 cas/10 000 anesthésies) mais potentiellement graves. Par ordre de fréquence décroissante, on trouve les abrasions cornéennes, les conjonctivites, la vision floue, les blessures chimiques, les traumatismes directs et la cécité. La durée prolongée de la chirurgie, le décubitus latéral, une chirurgie de la tête ou du cou, l’anesthésie générale et une intervention pratiquée le lundi sont des facteurs de risque indépendants de lésion oculaire peropératoire [38].
Les patients comateux en soins intensifs sont à risque de développer un ulcère cornéen [39] en raison d'une inoclusion palpébrale et/ou d'une sécheresse oculaire. Le respect de procédures opérationnelles standardisées permet de réduire le risque de complications ophtalmologiques en réanimation : aspiration trachéale en protégeant les yeux du malade ventilé, utilisation de systèmes d'aspiration clos, surélévation de la tête pour limiter l’œdème cornéen, utilisation de solutions lacrymales spécifiques pour nettoyer les yeux, éviter d'occlure les yeux avec une bande adhésive. Les séances prolongées de ventilation en décubitus ventral (DV), indiquées en cas de syndrome de détresse respiratoire aigu, sont responsables de chémosis majeurs manifestes, mais l’impact du DV sur l’épithélium cornéen n’a pas encore été documenté. Par ailleurs, l’augmentation de PIO induite par le DV prolongé pourrait être responsable d'une ischémie rétinienne, de manière similaire à ce qui est rapporté dans la chirurgie du rachis [40].
Chirurgien et anesthésiste-réanimateur participent conjointement à la prise en charge du patient avec l’objectif commun de lui assurer la meilleure qualité des soins possible dans des conditions de sécurité optimales. L’exercice partagé de spécialités complémentaires nécessite la définition préalable des compétences, fondée sur l’observance des règles de la déontologie médicale et une prise de décision collective, même si la responsabilité demeure individuelle (article 64 du Code de déontologie). Le partage réciproque d'informations entre l’opérateur et l’anesthésiste-réanimateur doit être complet. Le chirurgien doit informer l’anesthésiste-réanimateur des constatations faites à l’occasion de son examen médical, de la stratégie thérapeutique envisagée et du degré d'urgence de l’acte opératoire. De son côté, l’anesthésiste-réanimateur a le devoir d'informer l’opérateur de toute contre-indication d'ordre anesthésique, temporaire ou définitive, à l’intervention, comme de toute difficulté qui pourrait se présenter. En cas de désaccord entre l’anesthésiste-réanimateur et le chirurgien, tout doit être mis en œuvre pour parvenir à une conciliation dans un esprit de confraternité. En outre, la continuité des soins est due au patient quelles que soient les circonstances. Des condamnations ont été prononcées contre des chirurgiens et des anesthésistes-réanimateurs non pas en raison de fautes techniques propres à l’exercice de chaque discipline, mais pour un manque de coopération directement préjudiciable au patient. Par ailleurs, l’anesthésiste-réanimateur a le devoir d'informer le patient sur la technique anesthésique envisagée, ses avantages, ses inconvénients, ses risques propres, ses risques liés aux antécédents du patient, et ses alternatives le cas échéant [41].
Le choix de la technique d'anesthésie est conditionné par le degré d'urgence de l’intervention et le profil médico-psychologique du patient. Les plaies du globe et des voies lacrymales sont les deux indications privilégiées de l’anesthésie générale. La pratique de l’anesthésie locorégionale nécessite une formation théorique et pratique pour prévenir les complications potentielles. Le champ de la gestion de la douleur des urgences ophtalmologiques mérite d'être exploré.
[1] Girard B, Bourcier F, Agdabede I, Laroche L. Activité et épidÉmiologie d’un centre d’urgence en ophtalmologie. J Fr Ophtalmol 2002 ; 25 : 701‑11.
[2] Lamb K, James MF, Janicki PK. The laryngeal mask airway for intraocular surgery : effects on intraocular pressure and stress responses. Br J Anaesth 1992 ; 69 : 143‑7.
[3] Guerrier G, Boutboul D, Rondet S, et al. Comparison of a supraglottic gel device and an endotracheal tube in keratoplasty performed under general anesthesia : a randomized clinical trial. Cornea 2016 ; 35 : 37‑40.
[4] Vachon CA, Warner DO, Bacon DR. Succinylcholine and the open globe. Tracing the teaching. Anesthesiology 2003 ; 99 : 220‑3.
[5] Libonati MM, Leahy JJ, Ellison N. The use of succinylcholine in open eye surgery. Anesthesiology 1985 ; 62 : 637‑40.
[6] Moreno RJ, Kloess P, Carlson DW. Effect of succinylcholine on the intraocular contents of open globes. Ophthalmology 1991 ; 98 : 636‑8.
[7] Ripart J, Eledjam J. Anesthésie en Ophtalmologie. In : Bagnat-Guilly E, Ravussin P, Eledjam J, et al. Eds. Anesthésie pour chirurgie de la tête et du cou. Vol. II. Paris : Arnette ; 1999, p. 657‑776.
[8] Sator S, Wildling E, Schabernig C, et al. Desflurane maintains intraocular pressure at an equivalent level to isoflurane and propofol during unstressed non-ophthalmic surgery. British Journal of Anaesthesia 1998 ; 80 : 243‑4.
[9] Ghali AM, El Btarny AM. The effect on outcome of peribulbar anaesthesia in conjunction with general anesthesia for vitreoretinal surgery. Anaesthesia 2010 ; 65 : 249‑53.
[10] Bloomberg LB. Administration of periocular anesthesia. J Cataract Refract Surg 1986 ; 12 : 677‑9.
[11] Ripart J, Lefrant JY, Vivien B, et al. Ophthalmic regional anesthesia : medial canthus episcleral (sub-tenon) anesthesia is more efficient than peribulbar anesthesia : a doubleblind randomized study. Anesthesiology 2000 ; 92 : 1278‑85.
[12] Hamilton RRC. Complications of ophthalmic regional anesthesia. Ophthalmology Clinics 1998 ; 11 : 99‑114.
[13] Edge R, Navon S. Scleral perforation during retrobulbar and peribulbar anesthesia : risk factors and outcome in 50,000 consecutive injections. J Cataract Refract Surg 1999 ; 25 : 1237‑44.
[14] Vohra S, Good P. Altered globe dimensions of axial myopia as risk factors for penetrating ocular injury during peribulbar anaesthesia. British Journal of Anaesthesia 2000 ; 85 : 242‑5.
[15] Kallio H, Paloheimo M, Maunuksela EL. Haemorrhage and risk factors associated with retrobulbar/peribulbar block : a prospective study in 1383 patients. British Journal of Anaesthesia 2000 ; 85 : 708‑11.
[16] Nomura K, Singer DE, Aquavella JV. Corneal sensation after topical anesthesia. Cornea 2001 ; 20 : 191‑3.
[17] Boezaart A, Berry R, Nell M. Topical anesthesia versus retrobulbar block for cataract surgery : the patients’ perspective. Journal of Clinical Anesthesia 2000 ; 12 : 58‑60.
[18] Lippert FK, Yndgaard S, Berthelsen PG. Systemic beta-adrenoceptor function and ophthalmic beta-adrenergic blockers. Anesthesia & Analgesia 1996 ; 82 : 211‑3.
[19] Barequet IS, Soriano ES, Green WR, O’Brien TP. Provision of anesthesia with single application of lidocaine 2 % gel. Journal of Cataract & Refractive Surgery 1999 ; 25 : 626‑31.
[20] Ripart J, Prat-Pradal D, Vivien B, et al. Medial canthus episcleral (sub-Tenon) anesthesia imaging. Clinical Anatomy 1998 ; 11 : 390‑5.
[21] Li HK, Abouleish A, Grady J, et al. Sub-Tenon’s injection for local anesthesia in posterior segment surgery. Ophthalmology 2000 ; 107 : 41‑6.
[22] Guise P. Single quadrant sub-Tenon’s block. Evaluation of a new local anaesthetic technique for eye surgery. Anaesthesia and Intensive Care 1996 ; 24 : 241‑4.
[23] Mantovani C, Bryant A, Nicholson G. Efficacy of varying concentrations of hyaluronidase in peribulbar anaesthesia. British Journal of Anaesthesia 2001 ; 86 : 876‑8.
[24] Banerjee PJ, Bunce C, Charteris DG. Ozurdex® (a slow-release dexamethasone implant) in proliferative vitreoretinopathy : study protocol for a randomised controlled trial. Trials 2013 ; 14 : 1.
[25] Warner MA, Shields SE, Chute CG. Major morbidity and mortality within 1 month of ambulatory surgery and anesthesia. JAMA 1993 ; 270 : 1437‑41.
[26] Loon SC, Tay WT, Saw SM, et al. Prevalence and risk factors of ocular trauma in an urban south-east Asian population : the Singapore Malay Eye Study. Clinical & Experimental Ophthalmology 2009 ; 37 : 362‑7.
[27] Haberer J. Les complications de la sédation et de la prémédication en anesthésie ophtalmologique. Journal Francais d’Ophtalmologie 2000 ; 23 : 901‑6.
[28] Phillips WB, Tasman WS. Postoperative endophthalmitis in association with diabetes mellitus. Ophthalmology 1994 ; 101 : 508‑18.
[29] Pea F, Ferrari E, Pavan F, et al. Levofloxacin disposition over time in aqueous humor of patients undergoing cataract surgery. Antimicrobial Agents and Chemotherapy 2005 ; 49 : 2554‑7.
[30] Essex RW, Yi Q, Charles PG, Allen PJ. Post-traumatic endophthalmitis. Ophthalmology 2004 ; 111 : 2015‑22.
[31] Gupta A, Srinivasan R, Kaliaperumal S, Setia S. Microbial cultures in open globe injuries in southern India. Clinical & Experimental Ophthalmology 2007 ; 35 : 432‑8.
[32] Narang S, Gupta V, Gupta A, et al. Role of prophylactic intravitreal antibiotics in open globe injuries. Indian Journal of Ophthalmology 2003 ; 51 : 39.
[33] Williams N, Strunin A, Heriot W. Pain and vomiting after vitreoretinal surgery : a potential role for local anaesthesia. Anaesthesia and Intensive Care 1995 ; 23 : 444‑8.
[34] Mekhemar NA, El-agwany AS, Radi WK, El-Hady SM. Comparative study between benzydamine hydrochloride gel, lidocaine 5 % gel and lidocaine 10 % spray on endotracheal tube cuff as regards postoperative sore throat. Brazilian Journal of Anesthesiology 2016 ; 66 : 242‑8.
[35] Lam F, Lin YC, Tsai HC, et al. Effect of intracuff lidocaine on postoperative sore throat and the emergence phenomenon : a systematic review and meta-analysis of randomized controlled trials. PloS One 2015 ; 10 : e0136184.
[36] Lesin M, Dzaja Lozo M, Duplancic-Sundov Z, et al. Risk factors associated with postoperative pain after ophthalmic surgery : a prospective study. Therapeutics and Clinical Risk Management 2016 ; 12 : 93‑102.
[37] Roth WT, Doberenz S, Dietel A, et al. Sympathetic activation in broadly defined generalized anxiety disorder. Journal of Psychiatric Research 2008 ; 42 : 205‑12.
[38] Roth S, Thisted RA, Erickson JP, et al. Eye injuries after nonocular surgery. A study of 60,965 anesthetics from 1988 to 1992. Anesthesiology 1996 ; 85 : 1020‑7.
[39] McHugh J, Alexander P, Kalhoro A, Ionides A. Screening for ocular surface disease in the intensive care unit. Eye 2008 ; 22 : 1465.
[40] Kamel I, Barnette R. Positioning patients for spine surgery : avoiding uncommon position-related complications. World Journal of Orthopedics 2014 ; 5 : 425‑43.
[41] Conseil national de l’Ordre des médecins. Recommandations concernant les relations entre anesthésistes-réanimateurs, chirurgiens et autres spécialistes ou professionnels de santé. Décembre 2001. En ligne : http://www.conseil-national.medecin.fr/sites/default/ files/anesth.pdf
Urgence ophtalmologique en contexte exceptionnel: l’ophtalmologie en situation de crise et d’afflux massif
C. DOT , H. EL CHEHAB, E. AGARD
-
L’afflux massif de blessés oculaires peut survenir dans un contexte de conflit, d'attentat, de catastrophe civile, industrielle ou climatique.
-
Les lésions bilatérales et extra-oculaires sont fréquemment associées, nécessitant une prise en charge initiale pluridisciplinaire organisée.
-
L’oganisation du secours pré-hospitalier repose sur le plan rouge et la prise en charge hospitalière repose sur le plan blanc.
-
Les blessures oculaires représentent 15 % du total des blessures en contexte de conflit, et entre 8 et 18 % en contexte d'attentat explosif.
-
En cas d'explosion, les corps étrangers sont fréquents et doivent être traqués.
-
En cas d'intoxication par toxique chimique gazeux, les symptômes ophtalmologiques sont les premiers signes d'alerte. Ils apparaissant après une dizaine de minutes :
-
intoxication à la toxine botulique : troubles accommodatifs, diplopie, ptosis ou mydriase ;
-
intoxication organophosphorée : syndrome cholinergique avec myosis ;
-
intoxication ypérite : irritation forte conjonctivale, voire lésions cornéennes.
-
La prise en charge (PEC) du blessé oculaire, comme tout blessé, dépend du contexte environnemental. Si nous sommes rompus à une prise en charge individuelle dans nos structures d'urgence respectives, la PEC en situation de crise (guerre, attentat) est bien différente. L’élément déterminant est l’afflux massif des blessés, souvent multiblessés ou polytraumatisés, établissant des règles de PEC pour aboutir à une priorisation efficace de traitement des blessures afin de sauver le maximum de victimes. L’expérience du service de santé des armées (SSA) acquise au gré des siècles sur les champs de bataille, tant sur notre territoire qu’en opérations extérieures, a permis de modéliser progressivement cette PEC. Elle a été mise au service de la médecine civile et en particulier au profit de l’organisation de la médecine d'urgence en France, que nous connaissons, depuis le début du XX e siècle. Les événements récents ciblant notre territoire mettent malheureusement cette organisation spécifique à contribution et sous les feux de l’actualité.
La guerre est aussi ancienne que l’homme ! Clausewitz, général prussien écrit, dans son traité de stratégie militaire De la guerre en 1832, qu’elle est même le prolongement de l’action politique par d'autres moyens et fait partie de la nature même d'une société. La notion de guerre implique une atteinte massive de victimes.
La gestion du flux de ces victimes a évolué au cours des siècles grâce aux avancées médicales, aux progrès technologiques (au profit du développement des armes) et aux évolutions dans la conduite de la guerre. Le SSA a vu le jour sous Louis XIV avec l’édit du roi du 17 janvier 1708. Chaque régiment est alors doté d'un chirurgien et 50 hôpitaux sont créés. Leur mission est d'assurer le soutien sanitaire des troupes en temps de guerre mais aussi, et déjà, en temps de paix. Cela change alors radicalement la prise en charge du blessé ouvrant la voie à une nouvelle spécialité : la médecine militaire [1]. Au gré des siècles l’expérience croît et très vite apparaissent les grands principes de la médecine d'urgence que nous connaissons bien aujourd'hui tels que la lutte précoce contre les infections secondaires aux plaies, l’importance du délai de prise en charge (rapide), voire de la chirurgie conservatrice.
Nous aborderons dans ce sous-chapitre l’épidémiologie des blessures ophtalmologiques de guerre observées lors des conflits modernes. Elles sont d'un grand enseignement pour une meilleure connaissance des blessures actuellement observées lors des attentats suicides faisant tristement l’actualité. Puis nous traiterons de l’organisation spécifique liée à un afflux massif de blessés, en opération extérieure avec le SSA et sur notre territoire avec le plan blanc hospitalier. Nous pourrons alors observer le continuum évident des grands principes appliqués entre ces deux scénarios.
Les blessures oculaires observées évoluent avec le temps (fig. 2-7-1). L’œil ne représente que 0,3 % de notre surface corporelle, pourtant son atteinte est en progression constante atteignant plus de 15 % des blessés lors des derniers conflits. Cette augmentation constante rend compte d'une sous-déclaration vraisemblable lors des conflits du début du siècle, de l’augmentation de la survie au combat (taux de létalité au combat diminué par deux en 50 ans aux États-Unis) et donc de l’apparition de ces lésions, mais surtout d'une évolution du type de combat. Le conflit moderne est qualifié d'« asymétrique » (par opposition aux conflits conventionnels rencontrés jusqu’à la Seconde Guerre mondiale), car les armées sont face à un ennemi non affiché, infiltré dans la population locale, et se battant selon un système de guérilla [1]. Nous avons retrouvé ce mode d'action lors des attentats terroristes récents.
Les blessures observées ont évolué de pair avec les armes utilisées ; ainsi lors des derniers conflits, les lésions secondaires aux explosions ont nettement pris le pas sur les blessures plus conventionnelles par balle (tableau 2-7-1).
| Plaies par arme à feu (%) | Lésions par explosion (%) | |
|---|---|---|
| Guerre civile aux États-Unis | 91 | 9 |
| Première Guerre mondiale | 65 | 35 |
| Seconde Guerre mondiale | 27 | 73 |
| Corée | 31 | 69 |
| Vietnam | 35 | 65 |
| Irak | 19 | 81 |
Ces lésions dépendent de la puissance de la déflagration et de la distance de la victime à son épicentre. Plus la victime est proche de l’épicentre, plus elle risque de cumuler tous les effets délétères de l’explosion, associant possiblement : amputation traumatique, brûlure, blast (effet de souffle), blessures liées à la projection du corps et criblage lié à la projection de corps étrangers très divers à haute vélocité sous l’effet du souffle (fig. 2-7-2). Plus la victime est éloignée, moins elle est touchée pour n’être exposée qu’au criblage [2, 3].
Les lésions oculaires observées secondaires à l’explosion découlent de ce mécanisme. Il rend compte de la fréquence des corps étrangers (CE) superficiels et profonds (pénétrants ou perforants, voir chapitre 5.1.2 ), en l’absence de protection oculaire.
Ces lésions associent un traumatisme ouvert (plaie) avec un transfert d'énergie créant les lésions internes. Ce transfert d'énergie dépend de l’énergie cinétique initiale de la balle (fonction de la masse et de la vitesse), des caractéristiques du projectile et de son interaction avec l’organisme. On distingue trois comportements balistiques : le projectile chemisé qui ne bascule pas et qui crée une trajectoire rectiligne (coup de fleuret de l’arme de poing), le projectile qui bascule créant une cavité permanente entourée d'une cavité temporaire (fusil d'assaut ou FAMAS) et le projectile qui se fragmente créant une cavitation permanente plus importante avec des lésions maximales de destruction et de stretch tissulaire autour (fig. 2-7-3) [1, 2]. Ainsi le profil lésionnel est fonction du projectile, il est maximal avec les balles de guerre à fragmentation, l’orifice de sortie du projectile est alors difficilement prévisible.
En fonction du projectile, les lésions sont différentes avec une zone de cavitation permanente plus ou moins importante autour de laquelle on distingue une zone de cavitation réversible, zone de fortes forces de cisaillement et d'étirement tissulaire.
(D’après Hanna TN, Shuaib W, Han T, et al. Firearms, bullets, and wound ballistics : an imaging primer. Injury 2015 ; 46 : 1186-96. Copyright © 2015 Elsevier Ltd.)
Quel que soit le mécanisme de l’agent vulnérant, les lésions sont classées par la classification internationale Birmingham Eye Trauma Terminology (BETT) qui oppose les traumatismes à globe ouvert à ceux à globe fermé (fig. 2-7-4) [4, 5].
La répartition de l’onde de choc frontale, liée à l’explosion, est inégale sur la face. Bhardwaj et al. ont observé dans leur modélisation que la réflexion de l’onde de choc sur l’arête nasale et l’arcade orbitaire multiplie par 4 la pression transmise à l’œil. Avec le menton et les pommettes, les yeux sont les structures de la face les plus exposées à l’onde de choc (fig. 2-7-5) [4]. Celle-ci étant transmise de manière asymétrique, il en résulte des forces de cisaillement transmises aux structures oculaires aggravant les lésions. Weawer et al. ont montré qu’une pression de 0,5 MPa induisait un hyphéma dans 90 % des cas, une luxation cristallinienne dans 90 % des cas, une lésion rétinienne dans 90 % des cas, voire une rupture du globe dans 10 %% des cas [6].
L’œil est un organe très exposé, expliquant sa vulnérabilité en cas de blast. (D’après Bhardwaj R, Ziegler K, Seo JH, et al. A computational model of blast loading on the human eye. Biomechanics and Modeling in Mechanobiology 2014 ; 13 : 123-40.)
Weichel et al. ont analysé 523 traumatismes oculaires pris en charge lors des conflits en Irak (opération Desert Storm ) et en Afghanistan (opération Enduring Freedom ). Ils ont observé une forte prévalence de lésions par blast (79 % versus 9 % de lésions par arme à feu), une atteinte bilatérale oculaire dans plus d'un tiers des cas (37 %) et une atteinte ophtalmologique isolée dans seulement 28 % des cas. Ce dernier point illustre bien le « fait de guerre » et rend compte de lui-même de la PEC multidisciplinaire des victimes que nous avons à gérer [7]. Il est aussi important de souligner la fréquence des atteintes palpébrales (deux tiers des cas), ainsi que des plaies oculaires dans 38 % des cas. Parmi ces dernières, les plaies oculaires sont associées à un corps étranger intra-oculaire (CEIO) dans près de la moitié des cas (43 %%) et 9 % d'éclatement du globe sont rapportés. La gravité des lésions oculaires est significative puisque l’acuité visuelle est réduite à une perception lumineuse (PL +) dans 32 %% des cas [7].
Cockerham et al. ont quant à eux examiné 46 vétérans ayant été victimes d'un blast (par improved explosive device [IED]) avec traumatisme crânien à leur retour aux États-Unis. Dans 43 % d'entre eux, un blast oculaire était associé. Parmi ces derniers, trois quarts des cas présentaient une atteinte du segment antérieur (23 % d'atteinte cornéenne, 27 % de récession angulaire, 13 % de mydriase traumatique, 11 % de subluxation cristallinienne). Dans la moitié des cas une atteinte du segment postérieur était retrouvée (11 % d'hémorragie intravitréenne, 25 % d'atteinte rétinienne périphérique et 15 % d'atteinte maculaire) [8]. Les associations lésionnelles prévalaient, ce qui constitue comme nous le savons la complexité de « l’œil traumatique ».
L’analyse de la mission française à Kaboul portant sur 199 chirurgies de traumatologie oculaire rapporte également une part conséquente de l’activité chirurgicale liée aux CE palpébraux et/ou oculaire (30 % des actes) [9]. Ces données sont importantes à considérer dans la PEC des blessés oculaires dans un contexte d'explosion pour lesquels on doit se donner les moyens d'éliminer un CEIO systématiquement par un examen ophtalmologique soigneux (recherche de signes de balisage) et par un scanner orbitaire (à intégrer systématiquement au scanner corps entier initial).
Les CE de petit diamètre peuvent passer facilement inaperçus dans le contexte traumatique et les hémorragies sous-conjonctivales sont fréquentes (fig. 2-7-6).
Un CE de très petite taille à reflet brillant type aluminium flotte dans le vitré.
(Source : collection Corinne Dot.)
Enfin, les conflits récents par IED et « suicide bomber » impliquent la population civile, de ce fait nous avons à faire face également à de l’urgence pédiatrique.
Lors des derniers attentats récents utilisant des explosifs (voir ci-dessous), les lésions de la sphère oculaire ont été assez constantes affectant de 8 à 18 % des blessés, prévalence comparable à celle des conflits de ces quinze dernières années.
Les lésions oculaires observées suite à l’attentat contre un bâtiment fédéral à Oklahoma city en 1995 sont rapportées par Mines et al. Sur les 684 blessés survivants, 8 % avaient une lésion oculaire. L’atteinte oculaire était alors un facteur de risque de gravité (lésions associées plus fréquentes, index de sévérité plus élevé) [10].
L’attentat de Madrid en 2004 a eu pour particularité d'être une explosion dans un espace clos (un train, 191 morts et 512 blessés). Les lésions les plus fréquentes ont été celles de l’extrémité céphalique avec 18,5 % d'atteinte oculaire ; dans 87 % des cas, il s’agissait de traumatisme à globe fermé [11].
L’attentat à l’arrivée du marathon de Boston en 2013 a compté 264 blessés et 13,4 % de lésions oculaires, essentiellement du criblage péri-oculaire et de la surface oculaire (volatilisation des vitres) [12].
L’attentat du Bataclan à Paris le 13 novembre 2015 s’est différencié par son mode opératoire (armes balistiques et grenades). De ce fait, la fréquence des lésions oculaires a été moindre (8 blessés oculaires/351 blessés), toutes unilatérales. Cependant, la gravité a été extrême : sur les 8 blessés oculaires, 5 ont eu une acuité visuelle finale réduite à une PL et 2 sont devenus aveugles [13].
L’attentat du 14 juillet 2016 à Nice a présenté un nouveau mode opératoire avec un camion lancé sur la foule. Le bilan (85 décès, 434 blessés) compte essentiellement des lésions par écrasement et des traumatismes de contusion dus aux mouvements de foule. Un blessé oculaire pédiatrique a bénéficié d'un drainage d'hématome orbitaire (données non publiées, courtoisie du Pr Baillif).
Malgré la signature de la Convention sur l’interdiction des armes chimiques (CIAC) en 1993 à Paris interdisant la mise au point d'arme chimique, leur fabrication, leur stockage et leur utilisation, la menace chimique ne peut être exclue.
Les agents chimiques sont classés comme suit :
- –
les agents létaux comprennent les vésicants (ypérite et lewisite) et les suffocants (phosgènes) ;
- –
les toxiques généraux comprennent les neurotoxiques (organophosphorés avec le sarin, intoxication par inhalation ou contact cutané), les toxiques cellulaires (agents cyanés) et les toxiques sanguins hémolysants ;
- –
les agents incapacitants psychiques ou neutralisants (lacrymogène et agents vomitifs) [14].
L’agent chimique le plus connu est l’ypérite au soufre encore appelée « gaz moutarde » en raison de son odeur lors de l’explosion. Elle a été utilisée pour la première fois en 1917 par les troupes allemandes et plus récemment lors de la guerre Iran-Irak et par l’Irak contre la population kurde. Dans ce cas particulier, les symptômes ophtalmologiques sont les premiers signes apparaissant après l’explosion avec un intervalle libre d'une dizaine de minutes seulement. Il s’agit de larmoiement, de brûlures palpébrale et oculaire dans un premier temps, puis un œdème palpébral, une atteinte de cornée et une conjonctivite sévère apparaissent. Deux tiers des survivants ont des séquelles oculaires. Le reste du tableau est dominé par l’atteinte cutanée, respiratoire et hématologique. En cas d'explosion non identifiée, les signes ophtalmologiques constituent des signes d'alerte précieux [15]. La découverte accidentelle d'obus chimiques anciens a été récemment à l’origine d'intoxications chez des pêcheurs de la mer baltique ; les sites chimiques industriels vétustes sont aussi de potentielles menaces. L’utilisation de chlore en Irak en 2007 et la suspicion d'utilisation de pesticides organophosphorés (myosis immédiat associé à des signes respiratoires et neurologiques) en Afghanistan plus récemment illustrent la réalité de cette menace [1].
L’utilisation des armes biologiques est interdite par des conventions internationales depuis 1972, cependant la menace reste réelle tant au plan militaire que terroriste. Parmi les agents potentiels impliquant l’ophtalmologie, citons l’anthrax ou bacille de charbon (contamination d'enveloppes aux États-Unis en 2001, atteinte palpébrale), la variole avec une atteinte cutanée et le botulisme avec une atteinte initiale des paires crâniennes symétriques qui doit donner l’alerte (secte Aum, Japon 1994) [16].
Toute source radioactive peut conduire à une exposition à des rayonnements ionisants et peut aboutir à une contamination (par contact direct) et/ou irradiation (par propagation dans l’espace). Cette menace peut prendre la forme d'une explosion d'une bombe sale, d'un bombardement d'un établissement industriel ou encore d'une source scellée perdue ou abandonnée (cas le plus fréquent). L’ophtalmologie n’est pas directement impliquée dans ce contexte au stade aigu.
La prise en charge de ces victimes NRBC est spécifique au contexte, puisqu’elle impose une phase de décontamination préalable (chaîne de décontamination incluant protection des personnels soignants, masques, combinaisons) pouvant compliquer et retarder la PEC médicale. Cette PEC requiert une formation et un entraînement.
En cas d'afflux de blessés, saturant et/ou massifs, dépassant les moyens de PEC habituels, l’organisation obéit à la mise en place d'un plan spécifique : plan MASCAL ( massive casualties ) pour le SSA ; plans rouge et blanc de sécurité civile.
L’afflux massif est défini par l’arrivée en masse de blessés dépassant les limites de PEC de la structure accueillante. Il n’existe pas de consensus sur le nombre de blessés à partir duquel l’afflux provoque une inadéquation entre les besoins et les moyens, la sévérité des lésions étant déterminante.
Le but d'une organisation spécifique en cas d'afflux massif est d'apporter des soins efficaces au plus grand nombre de blessés. Pour ce faire, il est nécessaire d'établir une hiérarchisation des soins à réaliser, encore appelée « triage ». Introduit par le baron Larrey, dès les guerres napoléoniennes, il consiste à catégoriser les blessés en fonction du type de lésion, de la gravité, du pronostic et des ressources disponibles. Trier nécessite des outils ou scores, simples, rapides fiables et reproductibles (voir chapitre 2.5.3).
Le triage militaire repose sur les principes suivants :
- –
il est réalisé par un binôme anesthésiste-chirurgien ;
- –
il est fondé sur des critères purement médicaux (conventions de Genève en cas de conflit) ;
- –
il est dynamique et modifiable selon l’évolution des blessures.
Plusieurs types de scores de triage existent en fonction du type de perte (classique ou massive). Dans un souci d'harmonisation avec ses alliés, la SSA utilise une classification proche de celle de l’Organisation du traité de l’Atlantique nord (OTAN) comportant quatre catégories : T1 à T4 (tableau 2-7-2) [1].
| Catégorie | Définition | Ancienne catégorie | Terme anglo-saxon | Divers |
|---|---|---|---|---|
| T1 | Mise en jeu du pronostic vital, si aucun traitement chirurgical ou de≈réanimation n'est entrepris au plus vite |
| Immediate (urgent) | Déchocage et bloc immédiat (plaie du globe bilatérale) |
| T2 | Traitement chirurgical urgent mais qui peut être différé sans mettre en jeu le pronostic vital | Urgence relative (U2 et certaines U3) | Delayed | Bloc < 6 h (plaie du globe) |
| T3 | Patients nécessitant un geste chirurgical sans urgence ou ne nécessitant pas de traitement chirurgical | Blessés légers (certains Éclopés U3) | Minimal | Hospitalisation, puis geste chirurgicale (polycriblage superficiel) |
| T4 | Patients trop gravement blessés qui nécessiteraient un traitement lourd et long avec une chance de survie limitée | Urgences dépassées P4 | Expectant |
Les lésions ophtalmologiques bilatérales cécitantes sont classées T1 ou T2 en fonction du contexte ; une plaie unilatérale est classée T2, tandis que les autres lésions ophtalmologiques sont classées T3. Ainsi, l’urgence fonctionnelle et non pas seulement vitale est prise en compte, ce d'autant plus que la mortalité au combat a diminué avec le développement et l’enseignement du sauvetage au combat (de proximité). La protection oculaire est enseignée, elle a parfois recours à des procédés de terrain originaux (fig. 2-7-7).
(Source : collection Corinne Dot.)
En cas d'afflux massif, le plan MASCAL est déclenché par le médecin chef de l’hôpital militaire en opération extérieure. Il est mis en œuvre afin d'optimiser les moyens et définit précisément la place et la fonction de tous les personnels. Le bon déroulement d'un tel plan nécessite l’anticipation de sa survenue avec la conception préalable du plan lui-même (adapté à la structure) et l’entraînement répété du personnel. L’ophtalmologiste peut occuper, en plus de sa propre fonction, une fonction de writter au déchocage des hôpitaux de rôle 3 pour consigner sur support papier ou électronique les données de PEC initiale au déchocage, s’il n’est pas occupé sur sa spécialité (fig. 2-7-8).
(Source : collection Corinne Dot.)
Le triage est réalisé dès la PEC du blessé à tous les échelons de la chaîne de traitement et d'évacuation (triage évolutif). Les données du triage doivent être consignées sur un support (fiche médicale de l’avant) fixé au patient, afin d'être transmises d'échelon en échelon de la PEC (ramassage, évacuation, hospitalisation). Elle comporte différents éléments dont la date et l’heure de la PEC et les traitements administrés (heure, posologie, voies d'administration). L’antibiothérapie peut être mise en route dès le ramassage en cas de plaie.
Le mode d'évacuation vers l’échelon hospitalier (rôle 2 ou 3) est décidé en fonction du contexte et de la gravité (terrestre ou aérienne). À l’arrivée à l’hôpital, une réévaluation complète multidisciplinaire a lieu avec consigne des données sur un nouveau support papier préposé ou électronique qui suit dans le dossier du blessé. La traçabilité de la PEC est assurée malgré un afflux massif [1].
À une phase d'alerte/d'identification de l’agent en cause (clinique, détecteurs portables, dosimétrie) suit la mise en place d'unités préhospitalières de décontamination sous tentes pour la PEC des blessés (gants poudreurs pour fixer le toxique chimique, déshabillage, douche, contrôle dosimétrique, etc.) et leur évacuation secondaire. Les soignants doivent aussi se protéger en fonction du contexte (masque à gaz, combinaison).
Des signes ophtalmologiques peuvent orienter le diagnostic de l’attaque puisqu’ils sont parfois précoces voire inauguraux de la symptomatologie générale. Tel est le cas des troubles accommodatifs, d'une diplopie, d'un ptosis ou d'une mydriase signant une paralysie oculomotrice inaugurale dans le cadre d'une intoxication à la toxine botulique. Le syndrome cholinergique avec un myosis dans un contexte hostile doit faire craindre l’usage d'organophosphorés, les attaques chimiques par gaz ypérite sont aussi caractérisées par une irritation forte conjonctivale, voire des lésions cornéennes.
À l’échelon hospitalier, où se situe l’ophtalmologiste, les tableaux cliniques sont rapidement compliqués et du ressort de la réanimation ou de l’hématologie (radiocontamination), les soins ophtalmologiques sont alors symptomatiques et non spécifiques (lavage oculaire, vérification des culs-de-sac conjonctivaux, antiseptiques, lubrifiants topiques, voire mise en place d'anneau de symblépharon, etc.) [14].
Il existe une grande similitude entre les deux organisations. Cependant, quelques points diffèrent en raison du contexte :
- –
l’état de guerre complexifie l’extraction des blessés car la menace perdure. Lors d'un attentat, une fois l’explosion passée, les secours peuvent s’organiser en général au plus près des victimes dans une zone sécurisée, bien qu’un sur-attentat soit toujours possible ;
- –
les moyens d'évacuation sont numériquement supérieurs sur notre territoire, ainsi que les capacités d'accueil hospitalier.
Il n’en demeure pas moins que la gestion d'un afflux massif reste difficile et impose une organisation spécifique.
La gestion d'un afflux massif à l’échelon pré-hospitalier est coordonnée par le plan rouge.
Concernant l’accueil au niveau hospitalier, la gestion répond à un autre plan spécifique, le plan blanc d'urgence sanitaire. Il peut être mis en place dans les établissements de santé publics et privés. Il permet d'organiser l’accueil et la PEC d'un afflux massif de victimes d'un accident, d'une catastrophe, d'une épidémie ou d'un événement climatique meurtrier et durable.
Il peut être déclenché soit par un directeur d'établissement qui en réfère alors sans délai au préfet, soit directement par le préfet qui informe à son tour sans délai la direction générale de l’Agence régionale de santé (ARS) et le service d'aide médicale urgent (SAMU). Chaque établissement a la charge d'établir son plan blanc. Ce plan contient des consignes organisationnelles précises et les modalités de mise en place de la cellule de crise. Il doit être présenté aux différentes instances consultatives de l’établissement et en commission médicale d'établissement. Il est intégré au « plan blanc élargi » qui définit le rôle et la place de chacun des établissements au sein du département en situation exceptionnelle.
Au sein d'un établissement, le plan blanc définit :
- –
tous les moyens matériels et humains susceptibles d'être mobilisés (par exemple liste d'appel téléphonique) ainsi que leur emploi ;
- –
la cellule de crise dirigée par le directeur de l’établissement, chargée de gérer l’alerte ;
- –
l’organisation de l’accueil des victimes (accueil, tri, orientation) ;
- –
le rappel gradué des personnels ;
- –
la déprogrammation des activités non urgentes, l’inventaire des lits disponibles, la réouverture de lits, la mise à disposition de lits supplémentaires ;
- –
le renforcement des télécommunications et liaisons informatiques ;
- –
les transports et les transferts en lien avec les autres structures de soins ;
- –
l’intervention de la cellule d'urgence médico-psychologique pour soutenir les patients et leurs familles.
Dans cette organisation, l’ophtalmologiste de garde ou d'astreinte sera prévenu et appelé en cas d'avis spécialisé et pourra être amené à intervenir au bloc dans les premières heures de PEC en cas de plaie du globe (voir tableau 2-7-2). En fonction du contexte, la PEC chirurgicale pourra être multidisciplinaire avec un ordre chirurgical prédéfini au triage en général par l’anesthésiste.
- –
PIRATOX : en réponse à un acte terroriste qui use de produits chimiques militaire ou industriel. Rappelons pour exemple l’usage en 1994 et 1995 de sarin dilué (organophosphoré) au Japon par la secte Aum (dans le métro en 1995, 12 morts et 5 000 intoxiqués).
- –
PIRATOME : en réponse à un acte terroriste nucléaire ou radiologique (bombe sale dispersant des agents radioactifs). Distribution de chélateurs ou d'antidotes des isotopes radioactifs/comprimés d'iodure de potassium, comme cela a été le cas à Fukushima pour anticiper ou limiter la contamination interne (produits par la pharmacie centrale des armées).
- –
BIOTOX : en réponse à un acte terroriste utilisant des agents infectieux (virus, bactérie ou toxine). S’y rattachent un plan variole spécifique (avec vaccination collective en urgence) et un plan de distribution des médicaments (antibiotiques).
Ces plans gouvernementaux sont classés « confidentiel défense ».
L’échelon pré-hospitalier est coordonné selon quatre phases : alerte/identification de l’agent, établissement d'une zone de protection, protection du personnel et décontamination menée par la sécurité civile.
L’échelon hospitalier est calqué sur l’organisation du plan blanc, l’ophtalmologiste sera sollicité pour un traitement symptomatique : gestion de brûlures cutanées palpébrale, de kératoconjonctivites, d'une paralysie oculomotrice, etc. [14].
[1] Mérat S. Le blessé de guerre. Paris : Arnette ; 2014.
[2] Hanna TN, Shuaib W, Han T, et al. Firearms, bullets, and wound ballistics : an imaging primer. Injury 2015 ; 46 : 1186 96.
[3] Wightman JM, Gladish SL. Explosions and blast injuries. Annals of Emergency Medicine 2001 ; 37 : 664 78.
[4] Bhardwaj R, Ziegler K, Seo JH, et al. A computational model of blast loading on the human eye. Biomechanics and Modeling in Mechanobiology 2014 ; 13 : 123 40.
[5] Kuhn F, Maisiak R, Mann L, et al. The Ocular Trauma Score (OTS). Ophthalmology Clinics of North America 2002 ; 15 : 163 5, vi.
[6] Weaver AA, Kennedy EA, Duma SM, Stitzel JD. Evaluation of different projectiles in matched experimental eye impact simulations. Journal of Biomechanical Engineering 2011 ; 133 : 031002.
[7] Weichel ED, Colyer MH, Ludlow SE, et al. Combat ocular trauma visual outcomes during operations Iraqi and Enduring Freedom. Ophthalmology 2008 ; 115 : 2235 45.
[8] Cockerham GC, Rice TA, Hewes EH, et al. Closed-eye ocular injuries in the Iraq and Afghanistan wars. New England Journal of Medicine 2011 ; 364 : 2172 3.
[9] Giraud JM, May F, Dot C, et al. Ophtalmologie de guerre, ophtalmologie de paix, bilan de quatre ans de mission des ophtalmologistes militaires français en Afghanistan. Médecine et Armées 2011 ; 39 : 327 32.
[10] Mines M, Thach A, Mallonee S, et al. Ocular injuries sustained by survivors of the Oklahoma City bombing. Ophthalmology 2000 ; 107 : 837 43.
[11] Turégano-Fuentes F, Caba-Doussoux P, Jover-Navalón J, et al. Injury patterns from major urban terrorist bombings in trains : the Madrid experience. World Journal of Surgery 2008 ; 32 : 1168 75.
[12] Yonekawa Y, Hacker HD, Lehman RE, et al. Ocular blast injuries in mass-casualty incidents : the Marathon bombing in Boston, Massachusetts, and the fertilizer plant explosion in West, Texas. Ophthalmology 2014 ; 121 : 1670 6.e1.
[13] Butel NA, C. Benisty, D. Bodaghi, et al. Communication orale : prise en charge des patients victimes de traumatisme oculaire au cours des attentats du 13 novembre 2015 touchant l’agglomération parisienne. Congrès annuel de la Société française d’ophtalmologie ; 8 mai 2016. Paris, France.
[14] De Revel T, Gourmelon P, Vidal D, Renaudeau C. Menace terroriste approche médicale: nucléaire radiologique biologique chimique. Paris : John Libbey Eurotext ; 2005.
[15] Kehe K, Thiermann H, Balszuweit F, et al. Acute effects of sulfur mustard injury – Munich experiences. Toxicology 2009 ; 263 : 3 8.
[16] Maki DG. National preparedness for biological warfare and bioterrorism : smallpox and the ophthalmologist. Archives of Ophthalmology 2003 ; 121 : 710 1.
Prise en charge des urgences dans le monde civil
M.D. DE SMET
-
Les quatre maillons invariables et essentiels de la chaîne des secours sont : la prise de contact ; les premiers secours ; le transport vers l’entité de soins compétente ; l’accueil et la prise en charge du patient par une entité de soins compétente.
-
Dans les systèmes de santé organisés, la prise en charge pour les diverses catégories de patients est souvent la même.
-
Les différences de prises en charge des items d'urgence ophtalmologique portent principalement sur l’acheminement du patient, le contact initial selon la sévérité et la présence de protocoles formalisés.
-
Le contexte de prise en charge (externe, admission) varie sensiblement selon le lieu géographique pour un même item.
Le modèle français de prise en charge des urgences ophtalmologiques s’inscrit dans l’objectif d'un accès aux soins universel, médicalisé et non hiérarchisé. Tout patient en demande de soins oculaires non programmés peut prétendre avoir accès à un médecin dans la structure de son choix pour sa prise en charge. Évidemment, il existe bien d'autres modèles de prise en charge des demandes de soins non programmés en ophtalmologie (DSNPO) dans le monde, avec des objectifs et des organisations adaptés à leur environnement. Par ailleurs, la prise en charge des DSNPO est ajustée continuellement dans le temps. La nécessité d'un accès rapide et adéquat aux soins d'urgence en ophtalmologie est récente et liée aux avancées thérapeutiques des dernières années [1–5]. Hormis pour certains grands centres urbains situés dans des pays dotés d'un accès universel aux soins de santé, la prise en charge des urgences ophtalmiques reste embryonnaire en raison de multiples facteurs : les effectifs médicaux, leur formation, la fréquence et la nature des urgences, leur économicité, le milieu socioculturel du patient et de la société dans laquelle il évolue. La culture occidentale appelle à une prise en charge rapide voire immédiate des urgences médicales, alors que d'autres cultures peuvent être plus fatalistes (y portant peu d'importance, ou y voyant un destin auquel on ne peut se soustraire). Les patients en manque d'information sur l’accès aux soins (cas le plus souvent des immigrants de première génération et des populations vivant en marge de la société) peuvent venir tardivement aux urgences ou ne pas s’y présenter dans le cas d'une irrégularité de séjour, source de coûts supplémentaires lorsque ces patients sont finalement soignés. Beaucoup de patients n’appréhendent pas les progrès récents en ophtalmologie et donc l’importance d'être évalué par un personnel médical compétent.
Diverses structures ont donc évolué pour encadrer les urgences. On recense ainsi des grands centres urbains où une rationalisation des soins est possible, comme des petites localités urbaines ou rurales où la présence de soins ophtalmiques est limitée voire inexistante. En l’absence d'ophtalmologistes spécialisés ou de premiers recours, un certain nombre de questions se posent : les médecins généralistes d'une région ont-ils une formation adéquate en ophtalmologie ? Celle-ci peut-elle leur être fournie et doit-elle être requise ? Offrent-ils encore des soins d'urgence hors des heures de bureau ? Quel rôle jouent ou peuvent jouer les pharmaciens et les optométristes d'une région donnée ? Leurs réponses, qui varient fortement de par le monde, sont autant d'éléments qui modulent l’étendue et la qualité des soins offerts.
L’urgence est également relative. Un patient ou le soignant s’adresseront à un professionnel de la santé en fonction de la perception de la gêne, de la sévérité et de l’accès aux soins possible (voir chapitre 1.2 ). En 2004, les médecins généralistes au Royaume-Uni ont cessé de voir des cas urgents hors des heures de travail. Cette perte d'accès a eu pour conséquence une augmentation sur 10 ans de 70 % de la fréquentation des centres d'urgence existant, alors qu’aucune augmentation n’avait été observée dans la décennie précédente [6]. Cette tendance, selon le Collège royal des ophtalmologistes en Angleterre, va s’accentuer dans les années à venir avec environ 20 à 30 cas supplémentaires pour 1 000 personnes par an [7]. La gestion de cette demande et des expectatives des patients est donc un enjeu important, surtout dans nos sociétés vieillissantes et celles faisant face à une rationalisation des soins.
La définition d'une urgence ophtalmique est une autre question d'importance. Elle se doit d'être souple, car la sévérité des atteintes visuelles est souvent sous-estimée par l’intéressé et son entourage [8]. D’après les Britanniques, une définition commune de l’urgence ophtalmique pourrait se limiter à « toute condition angoissante affectant un œil, d'origine récente, ou perçue par le patient, son responsable, ou le professionnel de la santé référant, comme pouvant présenter un risque imminent à l’œil ou à la vision » [7].
Il n’est donc pas possible de répertorier ici les divers modèles de gestion des urgences existant à l’heure actuelle dans le monde, un pays, une région et parfois même une ville. Nous élaborerons en revanche un cadre général d'accès aux soins ainsi que des critères de comparaison pour les modèles d'organisation. Nous décrirons quelques modèles de fonctionnement développés dans divers contextes socio-économiques. Enfin, nous présenterons le cheminement de patients, avec divers niveaux d'urgence, à travers le labyrinthe des prises en charge possibles.
L’accès initial aux soins d'urgence, pour être utile et efficace, nécessite une succession particulière d'actes et de compétences. Cette succession constitue ce que l’on pourrait appeler une « chaîne des secours » et comprend quatre maillons essentiels : 1) la prise de contact ; 2) les premiers secours ; 3) le transport vers le soignant, l’hôpital ou le centre de soins ; 4) l’accueil et la prise en charge du traitement par un service médical compétent [9]. Chacune de ces étapes peut s’accomplir par un ou plusieurs moyens techniques.
La prise de contact peut être téléphonique vers un médecin de garde, un hôpital, un numéro d'urgence connu de la population – par exemple 911 en Amérique du Nord ou 122 dans la plupart des pays d'Europe [10] –, un service de garde, ou via Internet surtout dans des zones reculées [11]. Elle peut également se faire par un médecin généraliste dans un centre de soins de jour ou un optométriste équipé d'outils d'examens mobiles (parfois limité à un téléphone intelligent muni d'accessoires) dans la mesure où ces derniers sont reliés à un service de consultation par télémédecine. De tels services sont de plus en plus fréquents au Canada, en Australie, ou au pays de Galles [12]. La gratuité d'au moins une partie de ces services doit être assurée si l’on veut pouvoir rejoindre les personnes nécessitant des soins [13].
Les premiers secours seront donnés par un personnel paramédical si une ambulance ou une unité paramédicale a été réquisitionnée, par un proche ou la personne ayant appelé le centre d'urgence/de triage suivant les instructions qui lui auront été données, ou grâce à des informations obtenues en ligne.
Le transport dépendra des structures misent en place dans chacun des pays. Pour les urgences d'ordre local, il se limite souvent à la voiture d'un ami ou parent, ou à un taxi. Le transport par ambulance est utilisé de façon variable d'un pays à l’autre en raison du coût parfois élevé et non couvert par les assurances (cas de la Suisse par exemple). Le besoin d'un transport aérien est variable également. Aux Pays-Bas, un tel service n’est pas offert en ophtalmologie. Il se limite aux cas de traumatismes multiples où la vie du patient est en jeu. Au Canada, en Australie, en Nouvelle-Zélande et dans plusieurs États américains, il permet de transférer les patients nécessitant une procédure chirurgicale d'urgence (incluant les décollements de rétine) vers l’hôpital le plus proche pouvant offrir un tel service après accord d'un ophtalmologiste responsable et/ou parfois accord de l’assurance santé du patient.
L’accueil et la prise en charge locale dépendent éminemment de l’importance de la structure. Ils peuvent se limiter au traitement offert par le personnel du centre d'urgence (personnel infirmier, urgentiste) ou par l’ophtalmologiste de permanence. Dans les centres de plus grande importance, un triage est souvent effectué par un(e) infirmier(ière) spécialement formé(e) (voir chapitre 2.5.3), suivi d'un protocole formalisé de prise en charge pour diverses pathologies et/ou selon le niveau de traumatisme [14–16].
Pour qu’un service d'urgence soit efficace, il nécessite la mise en place d'une stratégie et d'une infrastructure adéquates [7, 9]. Elles existent de différentes manières selon les pays. Elles associent en règle générale :
- –
une réglementation juridique cohérente, de préférence au niveau national, adjointe d'un bon encadrement local et un plan d'action en cas de désastre naturel ou autre catastrophe [17] ;
- –
une coordination appropriée aux circonstances de l’endroit et du pays. Elle doit englober tous les intervenants directs et indirects (politiques, administratifs et financiers) [18]. Elle touche à tous les points notés à la section précédente : contact initial, diverses portes d'accès existantes en toutes circonstances, organisation des soins, accessibilité des soins. Elle tient compte d'une variabilité parfois surprenante des effectifs requis. La mise en place d'un plan comprenant à la fois les urgentistes, les hospitaliers et l’offre de soins privée (libérale en France) est souhaitable dans un tel contexte [13] ;
- –
des protocoles permettant de diriger les patients vers les intervenants appropriés, en fonction de la sévérité de l’urgence et aussi rapidement que possible. Il est donc utile d'avoir un outil de triage (la littérature en présente différents modèles, voir chapitre 2.5.3), complété de plusieurs protocoles pour juger de la sévérité des traumatismes oculaires [1, 4, 5, 14, 19, 20] ;
- –
des moyens de communication élaborés, dont on comprend l’importance évidente, auprès du public, mais également auprès des divers intervenants de prise en charge. Les personnels soignants ne sont pas toujours au fait des modalités et moyens à leurs dispositions, ni de leurs utilisations. Par ailleurs, la communication est d'autant plus nécessaire que le turn-over des équipes soignantes est important. L’information a vocation à être périodiquement rediffusée. Il faut s’assurer que tous soient au fait des mesures et protocoles en vigueur localement. La mise à disposition de manuels à l’échelon administratif le plus élevé, international ou national au mieux, comme en Australie, aide en cela [21] ;
- –
des standards de qualité et de performance adaptés au système de santé local et appliqués aux résultats cliniques, à la coordination des services, aux infrastructures et au cadre financier. Pour chaque organisation de soins d'urgence, en ophtalmologie notamment, il est nécessaire de tester la pertinence des mesures prises et de leur efficacité. Un audit devrait être effectué sur chaque système en vigueur selon un schéma consensuel établi d'avance [15, 16, 22] ;
- –
un financement adéquat de toutes ces mesures. La qualité du service d'urgence dépend beaucoup du financement qui lui est attribué [22]. Bien sûr, l’organisation et la rationalisation comptent. On constate cependant que dans les divers pays où il existe un système d'urgence, il est d'autant plus élaboré et orienté vers une prise en charge spécialisée en ophtalmologie que la direction de la santé locale lui attribue un financement.
Une planification et une prise en charge rigoureuse des urgences ophtalmologiques n’existent malheureusement pas partout. Elles sont souvent plus structurées dans des pays où les infrastructures de santé sont plus centralisées et gérées par l’État. Elles sont également plus efficaces dans ces pays où les infrastructures de santé sont récentes. Elles dépendent naturellement de l’ampleur de la population, des ressources et du degré de spécialisation des divers corps de métier. Nous avons mené une enquête sur différents modèles dans le monde. Ne pouvant décrire de manière exhaustive tous les systèmes de prise en charge des urgences ophtalmologiques de la planète, nous en avons sélectionné quelques-uns de manière arbitraire. Nous nous sommes intéressés à quelques modèles typiques d'urgences ophtalmologiques élaborés, intégrés à différents systèmes de santé sur différents continents.
Londres est la plus grande agglomération de l’Union européenne avec une population de 8 millions d'habitants [23]. Au cours de la dernière décennie, les soins d'urgence en ophtalmologie ont rapidement évolué sous l’influence des politiques gouvernementales et des besoins. En 2000, le plan National Health Service (NHS) a introduit un temps d'attente plafonné à 4 heures tout en injectant des fonds suffisants pour permettre la mise en place d'un service de pointe – par la création, en réalité, d'une nouvelle sur-spécialité dédiée aux urgences – au sein de deux hôpitaux de référence, le Moorfields Eye Hospital et le Western Eye Hospital. Un service d'urgence devant s’attendre à des flux variables de patients, ces deux centres de référence ont instauré la flexibilité dans les heures de travail, une meilleure disponibilité des personnels et une infrastructure adaptée à cette flexibilité horaire. De plus en plus de patients se sont présentés à ces deux hôpitaux à la fois pour les urgences et des consultations routinières. Cette affluence a placé les services d'urgence sous une pression constante, d'où la nécessité d'un triage avant même l’arrivée du patient quand cela est possible.
En parallèle, pour servir le « grand » Londres, un réseau à trois niveaux a été mis en place : des cliniques de jour à accès rapide aux heures d'ouverture limitées (de jour et en semaine) pour les urgences de bas niveau ; des urgences hospitalières avec des ophtalmologistes de garde (sur appel) 24 heures/24 où le patient est d'abord évalué par un urgentiste ou une infirmière spécialisée [16] ; les deux centres de référence susnommés.
Le modèle de Londres n’est pas appliqué dans d'autres villes anglaises, même en présence de centres universitaires. Les urgences ophtalmiques sont reçues et évaluées dans des centres classiques d'urgence au sein d'un hôpital. À Birmingham et dans des centres plus petits, l’évaluation se fait souvent sans triage préalable par des stagiaires dont la formation en ophtalmologie reste rudimentaire [24, 25]. Le patient n’est évalué par un ophtalmologiste qu’en deuxième instance et sur appel. À Liverpool, l’hôpital universitaire sert de centre de dernier recourt. Un protocole existe pour la prise en charge des urgences, établi par un ophtalmologiste. En revanche, aucun triage n’est effectué avant ou à l’arrivée du patient. La proximité du service d'ophtalmologie assure un suivi rapide durant le jour avec un ophtalmologiste (assistant en première instance et spécialiste sur appel) de garde en permanence de soins.
Il existe aux Pays-Bas un hôpital public dédié à l’ophtalmologie à Rotterdam. Ce dernier est un centre de référence pour les diverses pathologies oculaires. Les urgences proviennent de la grande région de Rotterdam mais aussi d'ailleurs. Le service d'urgence y est particulièrement bien développé. Un premier triage téléphonique est effectué, puis un second triage à l’arrivée du patient est réalisé par l’assistant de garde, secondé par des optométristes. Plusieurs appareils de mesure (ultrasons, optical coherence tomography [OCT]) sont directement disponibles. En fonction de l’urgence, le patient est admis ou non à l’hôpital. Dans la mesure du possible cette décision est prise à l’avance lors du premier contact téléphonique. Un ophtalmologiste est aux urgences durant les heures normales de travail. Sinon une garde séparée existe pour la rétine, les traumatismes oculaires et les autres services. Le transport se fait en général en voiture ou en ambulance. Dans certains cas, le transport public est pris en charge par l’assureur. Un protocole existe pour la prise en charge de désastre ou autre catastrophe naturelle.
D’autres centres tels que les hôpitaux universitaires et certains hôpitaux publics s’occupent également des urgences ophtalmiques, mais en fonction de leurs pôles d'excellence. En général, dans ces centres, un patient qui se présente aux urgences est d'abord vu par un urgentiste. Ce dernier prend contact avec l’ophtalmologue de garde et prend les dispositions nécessaires pour que le patient soit vu le jour même ou le lendemain par le médecin approprié. Il n’est pas rare que le patient soit adressé à un autre centre.
Au Canada, la gestion des soins de santé est du ressort des provinces [26]. Néanmoins la prise en charge est similaire d'une province à l’autre. Dans le cas des urgences, ce sont les urgentistes qui sont en première ligne et qui déterminent la nécessité d'impliquer les ophtalmologistes de garde. Dans les grands centres, il n’est pas rare d'avoir une garde différente pour les traumatismes, la rétine et l’ophtalmologie générale. Dans les centres de moindre importance, la garde est assurée par un ou plusieurs ophtalmol ogistes locaux. En Colombie-Britannique, la province est répartie en quatre districts. Des ophtalmologistes sont de garde dans chacun de ces districts. Dans la mesure où une urgence chirurgicale peut être prise en charge localement, l’intervention est réglée localement. Si l’urgence nécessite un transfert à un centre plus spécialisé (vers le centre où se trouve l’ophtalmologiste de garde), ce transfert se fait par le moyen le plus approprié : transport public, privé, ambulance ou hélicoptère. Le transport en hélicoptère est souvent pris en charge par le gouvernement dans la mesure où il est suivi d'une intervention chirurgicale. Dans le cas d'un décollement de rétine, le patient devra venir par ses propres moyens ou en transports publics dont les frais sont remboursés.
L’étude de la prise en charge des urgences aux États-Unis montre de très nombreuses approches sans qu’il y ait la moindre intégration. Les services publics fédéraux, des États, de l’administration des vétérans, des assureurs, des hôpitaux universitaires et privés se côtoient et se recoupent. Certains plans fédéraux permettent, par des accords bilatéraux avec les États, le transfert de patients de leur État vers des hôpitaux de référence d'un autre État moyennant l’accord d'un ophtalmologiste enregistré dans cet autre État. En général, le patient se rend aux urgences par ses propres moyens ou vérifie au préalable le type de transport pris en charge par son assureur. Dans bien des cas, c’est d'ailleurs l’assureur qui détermine en fonction de la description du cas, où le patient pourra se rendre pour des soins d'urgence. Dans le cas d'un transport sanitaire professionnalisé, le principe général pour les urgences ophtalmologiques, domaine spécialisé n’engageant généralement pas le pronostic vital à court terme, est celui du « charger et acheminer » ( scoop and run ) vers le centre compétent le plus proche effectué par les emergency medical technicians.
La prise en charge à Falls Church près de Washington DC, dans un hôpital ( suburban hospital ) lié à un service universitaire (Georgetown), débute par l’évaluation du patient par un médecin urgentiste. Il n’y a ni triage, ni protocole particulier. La vision est évaluée par le médecin ou un(e) infirmier(ière), mais aucune mesure de la tension oculaire n’est effectuée. Si nécessaire, un assistant de garde est appelé, qui par la suite prendra contact avec l’ophtalmologiste de garde le plus approprié. Il n’y a pas de protocole particulier mis en place pour l’impact ophtalmologique en cas de désastre naturel ou autre catastrophe.
La prise en charge des urgences ophtalmologiques dans la mégapole de Los Angeles est plurielle, comme généralement dans les grandes mégapoles mondiales. Il existe de nombreux recours pour les DSNPO. L’accès aux structures de soins privées, publiques ou universitaires ou le choix de celles-ci dépend principalement, comme souvent aux États-Unis, de la proximité du patient vis-à-vis du centre, de sa prise en charge financière par medicare et/ou par son(ses) assurance(s), de son autonomie, du choix du patient ou de ses habitudes de soins.
L’offre principale de soins ophtalmologiques d'urgence de l’UCLA n’est pas la seule à Los Angeles. Il existe d'autres structures d'ophtalmologie qui accueillent les urgences. Celle de l’UCLA est dispensée par le Jules (and Doris) Stein Eye Institute (JSEI), qui est totalement dédié aux soins ophtalmologiques. Il a été récemment jumelé avec le Doheny Eye Institute. Le JSEI fonctionne en collaboration avec l’hôpital général de l’UCLA (Ronald Reagan Hospital). Les patients en demande de soins oculaires non programmés sont reçus au JSEI selon deux circuits distincts et complémentaires :
- –
en continuité de soins, ils peuvent consulter des médecins vacataires seniors dans une unité de soins d'urgence individualisée ( critical care unit ), sous la responsabilité d'un médecin senior coordinateur identifié. Ils sont alors pris en charge selon un modèle de same day care, c’est-à-dire que leur item d'urgence peut être pris en charge dans son intégralité le jour même. Ils sont accueillis par un personnel d'accueil non soignant, puis orientés vers un ophtalmologiste. Le médecin ophtalmologiste concentre son examen et ses soins sur l’item d'urgence. Si une réfraction ou la mesure de l’acuité visuelle s’imposent, elles sont réalisées par un optométriste et font l’objet d'une facturation supplémentaire. Il n’existe pas de triage formalisé, car les ressources soignantes sont dimensionnées pour qu’il n’y ait pas de délai d'attente significatif. Les médecins de cette unité peuvent adresser les patients aux ophtalmologistes sur-spécialisés ou demander leur avis à tout moment. Toutes les sur-spécialités sont présentes sur le site. Les procédures chirurgicales d'urgence sont prises en charge au fil de l’eau dans le bloc d'ophtalmologie par les chirurgiens ophtalmologistes du JSEI en fonction des compétences requises ;
- –
en permanence de soins, comme à tout moment, les spécialistes juniors ( fellows ) en ophtalmologie qui sont autonomes chirurgicalement assurent une permanence d'astreinte ( on call ) pour chaque division sur-spécialitaire. Ils peuvent, dans les situations les plus critiques, s’assurer du soutien d'un ophtalmologiste titulaire universitaire ( faculty ). Les procédures chirurgicales d'urgence sont prises en charge à toute heure de la permanence dans le bloc de chirurgie générale de l’hôpital général, équipé pour les urgences ophtalmologiques.
Autour de son épicentre, le JSEI alimente en médecins et formations les centres périphériques de soins primaires de l’UCLA ( primary care centers ) de l’agglomération et certains hôpitaux de proximité ou dédiés ( suburban distant hospitals, veteran hospital, etc.). Ces structures accueillent aussi les DSNPO, administrent les premiers soins et les soins dans la limite des compétences des ophtalmologistes (souvent junior à l’UCLA) qui y pratiquent. Ces derniers adressent le cas échéant les patients nécessitant des soins plus évolués vers le JSEI, une fois ceux-ci stabilisés.
La Suisse connaît un système mixte à plusieurs niveaux. Fondé sur la chaîne des secours mentionnée plus haut, l’accès aux services d'urgence a fait l’objet de recommandations spécifiques comprenant :
- –
une réglementation juridique nationale cohérente y compris dans le domaine de la médecine de catastrophe ;
- –
des centrales d'alarme accessibles gratuitement par téléphone ;
- –
une organisation cantonale de la garde assurant la disponibilité de médecins d'urgence, provenant des hôpitaux et services de secours, et de praticiens installés ;
- –
un contrôle de qualité à chaque niveau [13].
Les centrales d'alarme effectuent un triage en fonction de la nature du problème évoqué par le patient, par le biais d'un programme détaillé où les mots clés tirés de la conversation permettent une orientation de plus en plus précise vers la nature et la sévérité du problème. Le patient localisé sur une carte géographique est alors orienté vers un spécialiste de garde qui détermine l’urgence du rendez-vous, ou bien une clinique privée ou un hôpital public ayant un service d'urgence approprié. Le patient est également libre de s’orienter lui-même vers un service d'urgence sans passer par la centrale. Ce système présente une grande flexibilité. La prise en charge financière des soins est identique quel que soit le mode choisi, seuls les frais de transport vers un centre d'urgence sont à la charge du patient, sauf assurance complémentaire adéquate.
À Riyadh, en Arabie saoudite, le King Khaled Eye Specialist Hospital (KKESH) est un centre de référence national en ophtalmologie desservant tout le pays. Lorsque les patients se présentent aux urgences, ils sont pris en charge par des assistants ou par des ophtalmologistes généralistes. Ces patients sont de préférence adressés après un premier contact informatisé avec un médecin référent. Lors de l’arrivée, un premier triage est effectué par un(e) infirmier(ière), puis un second par un(e) assistant(e). Ce qui peut être traité à l’urgence se fait sur place, alors que pour des soins plus complexes, le patient sera transféré vers les infrastructures dédiées aux sur-spécialités de l’hôpital pour l’ophtalmologie ou d'hôpitaux environnant pour les autres spécialités médico-chirurgicales. Un nombre significatif de patients se présentent avec des pathologies non ophtalmiques. L’hôpital s’occupe d'une partie de ces pathologies grâce à la présence d'un service d'exploration et d'imagerie complet (comprenant un computerized tomography-scan [CT-scan], et un appareil d'imagerie par résonance magnétique). En revanche, pour les pathologies engageant le pronostic vital, les patients sont transférés aux centres universitaires et leur soin ophtalmique est pris en charge par les ophtalmologistes de ces instituts. Si nécessaire le patient, une fois stabilisé, est renvoyé au KKESH pour la suite du traitement oculaire. Les ophtalmologistes titulaires sont présents au département des urgences durant le jour. Le soir et les week-ends, ce sont les assistants qui sont de permanence en première ligne. Les spécialistes sont alors d'astreinte. Les patients se rendent à l’hôpital par le moyen le plus expéditif. S’ils viennent de loin, sur approbation du médecin, le transport se fait par voie aérienne, au frais de l’État. Des plans sont en place pour la prise en charge en catastrophe.
La République de Sakha (Iakoutie) est le plus grand État de la Fédération de Russie. Sa superficie est de 3,1 millions de kilomètres carrés, dont 40 % se trouvent au-dessus du cercle polaire. Les conditions climatiques y sont extrêmes avec des chutes de température à −70 °C durant les mois d'hiver, occupant 9 des 12 mois de l’année. La densité de population y varie entre 0,01/km 2 dans les régions polaires à 2,8/km 2 plus au sud. L’organisation des soins d'urgence dans les zones urbaines est similaire aux autres régions de Russie et du monde. Si possible, le patient est acheminé vers un centre spécialisé. À défaut, mais sur accord, les soins d'urgence peuvent être fournis dans des cabinets privés. Dans les zones reculées, les soins primaires sont fournis par un personnel paramédical ayant reçu une formation ophtalmique de base. Le contact avec l’hôpital ophtalmique de la capitale, Iakoutsk, se fait par téléphone ou par Internet permettant un diagnostic et une prise en charge guidée par télémédecine. Dans certains centres urbains éloignés, des cliniques satellites permettent un suivi périodique à partir de la capitale. Si nécessaire et en fonction des conditions climatiques, l’évacuation sanitaire est effectuée vers la capitale.
Les tableaux 2-8-1 à 2-8-4 détaillent les prises en charge de divers types d'urgences ophtalmiques, dans des contextes différents selon les hôpitaux et les régions. Trois items ophtalmologiques de degré d'urgence et de nature de prise en charge différents (endophtalmie postopératoire ; perforation d'un globe oculaire ; décollement de la rétine) ont été opposés à un item ophtalmologique non urgent (patient se présentant avec des yeux secs). Le même scénario a été présenté à divers ophtalmologistes en leur demandant de décrire la prise en charge dans leur propre service.
| Prise en charge | Type d'hôpital | ||||||
|---|---|---|---|---|---|---|---|
| Universitaire Royaume-Uni | Universitaire Canada | Universitaire Pays-Bas | Spécialisé Pays-Bas | Spécialisé Arabie saoudite | Public Suisse | Clinique privée Suisse | |
| Triage téléphonique | N | N | N | O | O électronique sauf si présentation directe | N | O centre d'appel |
| Délai de contact | 1 h | 1–2 h | 30 min | 1 h | 20 min | 1 h | 30 min |
| Le délai peut-il être différent le jour versus permanence de soins ? | A | A | A | A | A | R | Contact direct avec l'Oph suite au triage |
| Premier contact à l'arrivée du patient | As | I | Ur | As | Triage | Triage | Triage |
| Second contact | Oph | Ur | As | Oph | I | I | Oph |
| Le patient peut-il être adressé ailleurs ? | N | N | N | N | N | Oui, soir et week-end | N |
| Le patient peut-il être admis à l'hôpital ? | O | N | N | O | O | O | N |
| Feedback | Écrit | Écrit | Écrit | Verbal | Écrit | Écrit | |
| Prise en charge | Type d'hôpital | ||||||
|---|---|---|---|---|---|---|---|
| Universitaire Royaume-Uni | Universitaire Canada | Universitaire Royaume-Uni | Spécialisé Pays Bas | Universitaire Royaume-Uni | Public Suisse | Universitaire Royaume-Uni | |
| Triage téléphonique | N | N | N | O | O électronique sauf si présentation directe | N | O centre d'appel |
| Délai de contact | 1 h | 1–2 h | 30 min | 30 min | 20 min | 1 h | < 30 min |
| Le délai peut-il être différent le jour versus permanence de soins ? | A | A | A | A | A | R | Contact direct avec l'Oph suite au triage |
| Premier contact à l'arrivée du patient | As | I | Ur | As | Triage | Triage | Triage |
| Second contact | Oph | Ur | As | Oph | I | I | Oph |
| Le patient peut-il être adressé ailleurs ? | N | N | N | N | N | Oui, soir et week-end | N |
| Le patient peut-il être admis à l'hôpital ? | O | O | O | O | O | O | O |
| Feedback | Écrit | Écrit | Écrit | Verbal | Écrit | Écrit | |
| Prise en charge | Type d'hôpital | ||||||
|---|---|---|---|---|---|---|---|
| Universitaire Royaume-Uni | Universitaire Canada | Universitaire Royaume-Uni | Spécialisé Pays Bas | Universitaire Royaume-Uni | Public Suisse | Universitaire Royaume-Uni | |
| Triage téléphonique | N | N | N | O | O électronique sauf si présentation directe | N | O centre d'appel |
| Délai de contact | 1 h | 1–2 h | 30 min | 30 min–1 h | 20 min | 1 h | 1 h |
| Le délai peut-il être différent le jour versus permanence de soins ? | A | A | A | A | A | A | R si nouveau Sinon contact direct avec Oph |
| Premier contact à l'arrivée du patient | As | I si non connu, sinon As | As | As | Triage | Triage | Triage si non connu |
| Second contact | Oph | As/Oph | Oph | Oph | I | I | Oph |
| Le patient peut-il être adressé ailleurs ? | N | N | N | N | N | N | N |
| Le patient peut-il être admis à l'hôpital ? | N | N | N | N | O | O | N |
| Feedback | Écrit | Écrit | Écrit | Verbal | Écrit | Écrit | |
| Prise en charge | Type d'hôpital | ||||||
|---|---|---|---|---|---|---|---|
| Universitaire Royaume-Uni | Universitaire Canada | Universitaire Royaume-Uni | Spécialisé Pays Bas | Universitaire Royaume-Uni | Public Suisse | Universitaire Royaume-Uni | |
| Triage téléphonique | N | N | N | O | O électronique sauf si présentation directe | N | O centre d'appel |
| Délai de contact | 2–4 h | 1–2 h | 30 min | 24 h | 20 min | 1 h | 24 h |
| Le délai peut-il être différent le jour versus permanence de soins ? | A | A | A | A | A | A | N rendez-vous durant une consultation de jour |
| Premier contact à l'arrivée du patient | Triage | I | Ur | As | Triage | Triage | Triage |
| Second contact | As | Clinique externe | Clinique externe | Oph | I | I | Oph |
| Le patient peut-il être adressé ailleurs ? | N | N | N | N | N | N | N |
| Le patient peut-il être admis à l'hôpital ? | N | N | N | N | N | N | N |
| Feedback | Écrit | Écrit | Écrit | Verbal | Écrit | Écrit | |
La prise en charge pour les diverses catégories de patients est souvent la même. On note pourtant des différences dans l’acheminement du patient dès le premier contact en fonction de la sévérité et de la présence de protocoles appropriés. Il en est de même de la prise en charge. L’endophtalmie dans certains centres implique un séjour à l’hôpital, alors que dans d'autres, le patient est traité en externe. De même, certains hôpitaux réfèrent systématiquement les patients vers d'autres centres hors leurs heures de continuité de soins.
La diversité des modèles de gestion en urgence rend toute synthèse impossible. Cette diversité est inhérente à de multiples facteurs. Ils incluent la diversité des modèles de gestion de la santé (privés versus publiques ou mixtes), l’accès aux soins, la densité de population, les effectifs médicaux et paramédicaux, l’existence d'un plan d'action national, régional ou local. Sans analyse approfondie, il est difficile de porter un jugement sur un système ou un autre. Les systèmes intégrés ou publiques semblent offrir une prise en charge plus cohérente dès le premier contact, qui est suivi des premiers soins et d'un transfert vers un centre de soins approprié. Cette structure n’est pas unique à l’ophtalmologie mais fait partie de tout plan général des soins d'urgence, dont le financement doit inclure l’ophtalmologie. Dans les zones reculées, la télémédecine et Internet semblent des moyens utiles et intéressants de rejoindre des populations éloignées. L’adjonction d'un personnel paramédical local formé aux urgences ophtalmiques peut être particulièrement utile.
Remerciements : Nous aimerions remercier les médecins suivants qui ont bien voulu répondre à nos questions au sujet des systèmes de santé dans leurs régions respectives : M. Becker – hôpital Trimli, Zurich, Suisse ; D. lanetta – St Paul's Eye Unit, hôpital du Royal Liverpool University, Royaume-Uni ; K. Faridpooya – Rotterdam Eye Hospital, Rotterdam, Pays Bas ; F. Kuhn – Helen Keller Foundation, Birmingham AL, États-Unis ; D. Maberley – département d'ophtalmologie, université de Colombie-Britannique, Canada ; S. Mansour – université Georges Washington, The Virginia Retina Center, Warrenton, VA, États-Unis ; R. Feit-Leichman et J.P. Hubschman – Los Angeles, CA, États-Unis ; M. Mura – King Khaled Eye Hospital, Riyahd, Royaume de l’Arabie saoudite ; S. Tan – département d'ophtalmologie, université d'Amsterdam, Pays Bas ; E.K. Zakharova – hôpital d'ophtalmologie de la république de lakoutsk, Russie.
[1] Bourges JL, Boutron I, Monnet D, Brezin AP. Consensus on Severity for Ocular Emergency : The BAsic SEverity Score for Common OculaR Emergencies [BaSe SCOrE]. J Ophthalmol 2015 ; 2015 : 576983.
[2] Rudkin AK, Lee AW, Chen CS. Central retinal artery occlusion : timing and mode of presentation. Eur J Neurol 2009 ; 16 : 674¬7.
[3] Mercieca K, Jones NP. Treatment of acute anterior uveitis in the community, as seen in an emergency eye centre. A lesson for the general practitioner ? Eur J Gen Pract 2012 ; 18 : 26¬9.
[4] Lindfield D, Das-Bhaumik R. Emergency department management of penetrating eye injuries. Int Emerg Nurs 2009 ; 17 : 155¬60.
[5] Lee CH, Lee L, Kao LY, et al. Prognostic indicators of open globe injuries in children. Am J Emerg Med 2009 ; 27 : 530¬5.
[6] NHS Digital. Hospital accident and emergency activity. 2015–2016. Published 10 january 2017. En ligne :https://digital.nhs.uk/media/30351/Hospital-Accident-and-Emergency- Activity-2015¬16-Summary-Report/Any/acci-emer-atte-eng-2015¬16-rep
[7] MacEwen C, Buchan J. The way forward : options to help meet demand for the current and future care of patients with eye disease. En ligne : https://www.rcophth.ac.uk/wp-content/uploads/2015/10/RCOphth-The-Way-Forward-Glaucoma-300117.pdf
[8] Pison A, Rothschild PR, Mehanna C, et al. Comparing the subjective and the objective severity of affections observed at emergency room in ophthalmology. Investigative Ophthalmology & Visual Science 2014 ; 55 : 6101.
[9] Ribordy V, Schöttker P, Yersin B. Accès aux soins d’urgence : organisation et utilité de la chaîne des secours. Revue Médicale Suisse 2006 ; 2 : 1830-5.
[10] List of emergency telephone numbers. En ligne : https://en.wikipedia.org/wiki/List_ of_emergency_telephone_numbers
[11] Kumar S, Yogesan K, Hudson B, et al. Emergency eye care in rural Australia : role of internet. Eye (Lond) 2006 ; 20 : 1342¬4.
[12] Dragnev D, Mahmood U, Williams C, Kulshrestha M. Teleophthalmology : eye care in the community. In : Madhavan R, Khalid S. Eds. Telemedicine. Rijeka : InTech ; 2013.
[13] Forum du sauvetage. Thèses (Leitlbild) de la FMH pour le domaine du sauvetage en Suisse. Bull Med Suisse 2010 ; 91 : 1215¬6.
[14] Alizadeh R, Panahi F, Saghafinia M, et al. Impact of trauma dispatch algorithm software on the rate of missions of emergency medical services. Trauma Mon 2012 ; 17 : 319¬22.
[15] AlSamnan MS, Mousa A, Al-Kuwaileet S, AlSuhaibani AH. Triaging self-referred patients attending ophthalmic emergency room. Saudi Med J 2015 ; 36 : 678¬84.
[16] Kirkwood BJ, Pesudovs K, Loh RS, Coster DJ. Implementation and evaluation of an ophthalmic nurse practitioner emergency eye clinic. Clin Exp Ophthalmol 2005 ; 33 : 593¬7.
[17] Barak A, Verssano D, Halpern P, Lowenstein A. Ophthalmologists, suicide bombings and getting it right in the emergency department. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 199¬203.
[18] Berchet C. Emergency care services : trends, drivers and interventions to manage the demand. Paris : OECD Publishing ; 2015.
[19] Rossi T, Boccassini B, Iossa M, et al. Triaging and coding ophthalmic emergency : the Rome Eye Scoring System for Urgency and Emergency (RESCUE) : a pilot study of 1,000 eye-dedicated emergency room patients. Eur J Ophthalmol 2007 ; 17 : 413¬7.
[20] Szijarto Z, Gaal V, Kovacs B, Kuhn F. Prognosis of penetrating eye injuries with posterior segment intraocular foreign body. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 161¬5.
[21] Sehu W. Eye emergency manual : an illustrated guide. second edition. 2009. En ligne : https://www.aci.health.nsw.gov.au/__data/assets/pdf_file/0013/155011/eye_manual.pdf
[22] OECD. Reviews of health care quality : Norway 2014.
[23] Smith HB, Daniel CS, Verma S. Eye casualty services in London. Eye (Lond) 2013 ; 27 : 320¬8.
[24] Ah-Kee EY, Scott RA, Shafi A, et al. Are junior doctors in today’s NHS competent in managing ophthalmic cases in the emergency department ? Eye (Lond) 2016 ; 30 : 164.
[25] Murray PI, Benjamin M, Oyede O. Can general A&E doctors manage common eye emergencies ? Eye (Lond) 2016 ; 30 : 1399¬400.
[26] Alangh M, Chaudhary V, McLaughlin C, et al. Ophthalmic referrals from emergency wards-a study of cases referred for urgent eye care (The R.E.S.C.U.E Study). Can J Ophthalmol 2016 ; 51 : 174¬9.